题目内容
【题目】近日,《自然—通讯》发表了我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。回答下列问题:
(1)下列N原子的电子排布图表示的状态中,能量由低到高的顺序是______(用字母表示)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)与硼元素处于同周期且相邻的两种元素和硼元素的第一电离能由大到小的顺序是_______(用元素符号表示)。
(3)![]() 的立体构型为______________,中心原子Si的轨道杂化类型为_____________。
的立体构型为______________,中心原子Si的轨道杂化类型为_____________。
(4)与六元环状物质![]() 互为等电子体的有机分子为____________(填结构简式)。
互为等电子体的有机分子为____________(填结构简式)。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作![]() ,实际上它的结构单元是由两个
,实际上它的结构单元是由两个![]() 和两个
和两个![]() 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成![]() 。其阴离子的结构如图所示,它的阴离子可形成链状结构。
。其阴离子的结构如图所示,它的阴离子可形成链状结构。
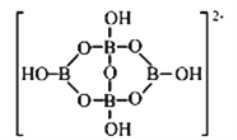
①该晶体中不存在的作用力是_____________(填选项字母)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
②阴离子通过____________(填作用力的名称)相互结合形成链状结构。
(6)![]() 硬度大、熔点高,常作结构陶瓷材料。
硬度大、熔点高,常作结构陶瓷材料。![]() 与
与![]() 结构相似,请比较二者熔点高低,并说明理由:_____________________。
结构相似,请比较二者熔点高低,并说明理由:_____________________。
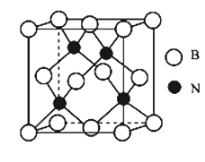
(7)立方氮化硼属于原子晶体,其晶胞结构如图所示。其中硼原子的配位数为____________,已知立方氮化硼的密度为![]() ,B原子半径为
,B原子半径为![]() ,N原子半径为
,N原子半径为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则该晶胞中原子的空间利用率为_____________________(用含
,则该晶胞中原子的空间利用率为_____________________(用含![]() 的代数式表示)。
的代数式表示)。
【答案】![]()
![]() 正四面体形
正四面体形 ![]()
![]() C 氢键
C 氢键 ![]() 的熔点高于
的熔点高于![]() 的熔点,因为C的原子半径小于Si原子半径,C-N键的键长小于Si-N键的键长,C-N键的键能大于Si-N键的键能 4
的熔点,因为C的原子半径小于Si原子半径,C-N键的键长小于Si-N键的键长,C-N键的键能大于Si-N键的键能 4 ![]()
【解析】
(1)原子核外电子排布中,电子所占的轨道能级越高,该原子的能量越高,轨道能量:![]() ,据此比较;
,据此比较;
(2)同周期元素从左至右,第一电离能呈增大趋势,但是Be原子的2p能级为全空的稳定状态;
(3)根据价层电子对理论和杂化轨道理论判断;
(4)原子总数相同,价电子总数相同的分子或离子互为等电子体;
(5)①活泼金属和酸根离子之间存在离子键、非金属元素之间易形成共价键,含有孤电子对和含有空轨道的原子之间存在配位键;分子之间存在范德华力,水分子之间存在氢键;
②该阴离子通过氢键相互结合形成链状结构;
(6)![]() 、
、![]() 都是原子晶体,比较C-N键的键能与Si-N键的键能的大小关系,从而确定二者熔点高低;
都是原子晶体,比较C-N键的键能与Si-N键的键能的大小关系,从而确定二者熔点高低;
(7)根据晶胞结构图分析,利用均摊法确定化学式,B原子的配位数即距离B原子最近且距离相等的N原子的个数;计算晶胞的体积和![]() 原子的总体积,进而计算晶胞中原子的空间利用率为。
原子的总体积,进而计算晶胞中原子的空间利用率为。
(1)原子核外电子排布中,电子所占的轨道能级越高,该原子的能量越高,轨道能量:![]() ,根据占据2p轨道电子的数目可知,A能量最低,D能量最高,根据占据2s轨道电子的数目可知,能量:
,根据占据2p轨道电子的数目可知,A能量最低,D能量最高,根据占据2s轨道电子的数目可知,能量:![]() ,故能量由低到高的顺序是
,故能量由低到高的顺序是![]() ,故答案为:
,故答案为:![]() ;
;
(2)同周期元素从左至右,第一电离能呈增大趋势,但是Be原子的2p能级为全空的稳定状态,因此Be的第一电离能比B的大,则第一电离能:![]() ,故答案为:
,故答案为:![]() ;
;
(3)![]() 的中心原子Si的孤电子对数
的中心原子Si的孤电子对数![]() ,价层电子对数
,价层电子对数![]() ,故
,故![]() 的立体构型为正四面体形,Si原子的轨道杂化类型为
的立体构型为正四面体形,Si原子的轨道杂化类型为![]() ,故答案为:正四面体形;
,故答案为:正四面体形;![]() ;
;
(4)原子总数相同,价电子总数相同的分子或离子互为等电子体,与![]() 互为等电子体的有机物的结构简式为
互为等电子体的有机物的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)①钠离子和酸根离子之间存在离子键,BO和OH原子之间存在共价键,B和O原子之间还存在配位键,水分子之间存在范德华力和氢键,所以该物质中不含金属键,故答案为:C;
②该分子中羟基上的氢原子和另一个羟基上的O原子形成氢键,所以该阴离子通过氢键相互结合形成链状结构,故答案为:氢键;
(6)![]() 、
、![]() 都是原子晶体,C的原子半径小于Si的原子半径,C-N键的键长小于Si-N键的键长,则C-N键的键能大于Si-N键的键能,导致
都是原子晶体,C的原子半径小于Si的原子半径,C-N键的键长小于Si-N键的键长,则C-N键的键能大于Si-N键的键能,导致![]() 的熔点高于
的熔点高于![]() 的熔点,故答案为:
的熔点,故答案为:![]() 的熔点高于
的熔点高于![]() 的熔点,因为C的原子半径小于Si原子半径,C-N键的键长小于Si-N键的键长,C-N键的键能大于Si-N键的键能;
的熔点,因为C的原子半径小于Si原子半径,C-N键的键长小于Si-N键的键长,C-N键的键能大于Si-N键的键能;
(7)由图可知,立方氮化硼晶胞中每个N原子连接4个B原子,化学式为![]() ,故晶胞中每个B原子也连接4个N原子,即B原子的配位数为4,晶胞的质量为
,故晶胞中每个B原子也连接4个N原子,即B原子的配位数为4,晶胞的质量为![]() ,晶胞的体积为
,晶胞的体积为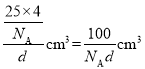 ,
,![]() 原子的总体积为
原子的总体积为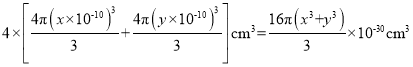 ,则晶胞中原子的空间利用率为
,则晶胞中原子的空间利用率为![]() ,故答案为:4;
,故答案为:4;![]() 。
。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案