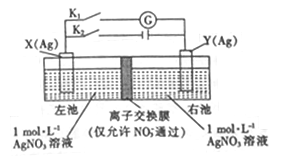
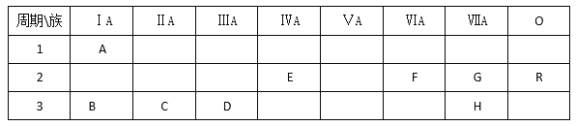
题目内容
【题目】在厨房做饭,不慎将少量自来水洒在天然气火焰上,火焰立即呈黄色,该现象说明自来水中一定含有( )
A.钾元素
B.钡元素
C.铜元素
D.钠元素
【答案】D
【解析】钠元素的焰色反应显黄色,火焰立即呈黄色,说明自来水中含有钠元素,故选项D正确。
故答案为:D
根据金属元素的焰色反应进行判断含有的元素即可。

【题目】A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)F在周期表中的位置是____________,
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为____________ ,其水溶液与F单质反应的化学方程式为___________________________________________________;在产物中加入少量KI,反应后加人CC14并振荡,有 机层显____________色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
c | 化学组成为BDF2 |
a的化学式为______;b的化学式为_______________;c的电子式为_________________;
【题目】(Ⅰ)某化学兴趣小组要完成中和热的测定.回答下列问题:
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5molL﹣1盐酸、0.55molL﹣1NaOH溶液,实验尚缺少的玻璃用品是_______.
(2)已知:反应后溶液的比热容c为4.18J·℃﹣1g﹣1,0.5molL﹣1盐酸和0.55mol·L﹣1NaOH溶液的密度均为1g·cm﹣3.实验时记录的实验数据如下:
实验 次数 | 反应物及用量 | 溶 液 温 度 | ||
t1 | t2 | |||
1 | 50mL0.55molL-1NaOH溶液 | 50mL.0.5molL-1HCl溶液 | 20℃ | 23.3℃ |
2 | 50mL0.55molL-1NaOH溶液 | 50mL.0.5molL-1HCl溶液 | 20℃ | 23.5℃ |
①盐酸和氢氧化钠反应的中和热△H1=____________(保留两位小数)
②已知:CH3COOH(aq)![]() CH3COO-(aq)+H+(aq) △H2>0 ,
CH3COO-(aq)+H+(aq) △H2>0 ,
CH3COOH(aq)+OH-(aq)= CH3COO-(aq)+H20(l) △H3 则△H3_____△H1(填“>”、“<”、“=”)
(Ⅱ)某实验小组利用硫酸酸化的KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。该小组实验方案如下(实验测定KMnO4溶液完全褪色时间)。回答下列问题:
实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
(3)上述反应的离子方程式为______________________________________
(4)t1_____ t2(填“>”、“<”、“=”),其理由是__________________
(5)实验②和实验③两组实验的目的是______________________________
(6)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。
猜想②:__________________(请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是______。
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰