题目内容
将15g两种金属的混合物与足量的稀H2SO4反应后得到标准状况下的氢气11.2L,则这两种金属不可能是( )A.Mg和Al
B.Mg和Fe
C.Al和Fe
D.Al和Cu
【答案】分析:假设金属都为+2价,根据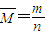 计算金属混合物的平衡相对原子质量,利用平均值法判断.
计算金属混合物的平衡相对原子质量,利用平均值法判断.
解答:解:11.2L氢气的物质的量为: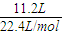 =0.5mol,
=0.5mol,
假设金属都为+2价,则金属混合物的平均相对原子质量为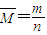 =
=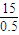 =30,
=30,
A、Mg的相对原子质量为24,当Al的化合价为+2价时,可看成其相对原子质量为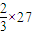 =18,二者都小于30,平均值不可能为30,故A错误;
=18,二者都小于30,平均值不可能为30,故A错误;
B、Mg的相对原子质量为24,Fe的相对原子质量为56,平均值可能为30,故B正确;
C、当Al的化合价为+2价时,可看成其相对原子质量为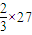 =18,Fe的相对原子质量为56,平均值可能为30,故C正确;
=18,Fe的相对原子质量为56,平均值可能为30,故C正确;
D、当Al的化合价为+2价时,可看成其相对原子质量为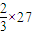 =18,Cu与稀硫酸不反应,当Al的质量为9g时,可生成11.2L氢气,符合题意,故D正确.
=18,Cu与稀硫酸不反应,当Al的质量为9g时,可生成11.2L氢气,符合题意,故D正确.
故选A.
点评:本题考查混合物的计算,题目难度中等,本题利用平均值法计算,注意化合价与相对原子质量的关系.
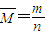 计算金属混合物的平衡相对原子质量,利用平均值法判断.
计算金属混合物的平衡相对原子质量,利用平均值法判断.解答:解:11.2L氢气的物质的量为:
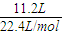 =0.5mol,
=0.5mol,假设金属都为+2价,则金属混合物的平均相对原子质量为
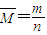 =
=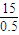 =30,
=30,A、Mg的相对原子质量为24,当Al的化合价为+2价时,可看成其相对原子质量为
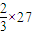 =18,二者都小于30,平均值不可能为30,故A错误;
=18,二者都小于30,平均值不可能为30,故A错误;B、Mg的相对原子质量为24,Fe的相对原子质量为56,平均值可能为30,故B正确;
C、当Al的化合价为+2价时,可看成其相对原子质量为
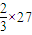 =18,Fe的相对原子质量为56,平均值可能为30,故C正确;
=18,Fe的相对原子质量为56,平均值可能为30,故C正确;D、当Al的化合价为+2价时,可看成其相对原子质量为
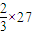 =18,Cu与稀硫酸不反应,当Al的质量为9g时,可生成11.2L氢气,符合题意,故D正确.
=18,Cu与稀硫酸不反应,当Al的质量为9g时,可生成11.2L氢气,符合题意,故D正确.故选A.
点评:本题考查混合物的计算,题目难度中等,本题利用平均值法计算,注意化合价与相对原子质量的关系.

练习册系列答案
相关题目