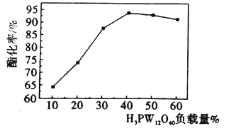
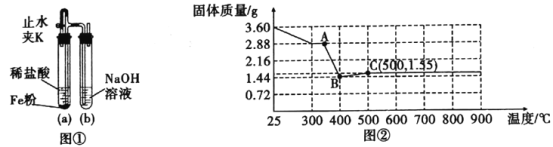
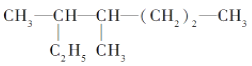题目内容
【题目】将一定量纯净的 X 置于某 10 L 容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s) ![]() 2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是( )
2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是( )
温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
K/(×10-8 mol3·L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
A.该反应在高温下可能自发
B.若Z的体积分数不再随时间变化时表示反应达平衡状态
C.若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大
D.35℃时,达平衡时,X分解了0.03 mol
【答案】B
【解析】
A、由表可知温度越高,平衡常数K越大,所以反应X(s)2Y(g)+Z(g)为吸热反应,△H>0,反应中气体的物质的量增大,△S>0,根据△G=△H-T△S,反应在高温的条件下能自发进行,故A正确;
B、反应X(s)2Y(g)+Z(g)中,Y和Z都是气体,而X是固体,所以Z的体积分数不随时间变化而变化,所以Z的体积分数不变不能作平衡状态的标志,故B错误;
C、压缩容器体积,相当于增大压强,平衡逆向移动,所以再次达平衡后,n(X)比原平衡大,故C正确;
D、35℃平衡常数为10.8,
X(s)2Y(g)+Z(g),
起始量(mol): a 00
变化量(mol): b2b b
平衡量(mol):a-b2b b
所以K=![]() =10.8,解得:b=0.03 mol,故D正确;
=10.8,解得:b=0.03 mol,故D正确;
故选B。

 智慧小复习系列答案
智慧小复习系列答案【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D
【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.2000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1) 配平离子方程式:______MnO4-+HSO3-+H+=Mn2++SO42-+H2O。
(2)用KMnO4进行滴定时,KMnO4溶液应装在_______________中,判断滴定终点的现象是_______。
(3)下列操作会导致测定结果偏高的是_________。
A. 盛装未知浓液的锥形瓶用蒸馏水洗过,未用待测液润洗
B. 未用标准浓度的酸性KMnO4溶液润洗滴定管
C. 观察读数时,滴定前仰视,滴定后俯视
D. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4) 根据下表测定的实验数据,计算KMnO4溶液体积的平均值为___mL;NaHSO3溶液的物质的量浓度为___mol/L(数据精确到0.1)。
试验编号 | 待测NaHSO3溶液的体积/ mL | KMnO4溶液体积/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |