题目内容
取对水蒸气的相对密度为0.4的CO和H2组成的混合气体若干克,通入到盛足量的Na2O2固体粉末的容器中,并同时加入少量的O2,电火花引燃,充分反应后,称重发现固体粉末的质量增加了2.1g,则原混合气体中CO和H2的质量比为
- A.1:4
- B.2:3
- C.6:5
- D.7:2
D
分析:根据相对分子质量,用十字交叉方法计算两种气体的物质的量比值,进而计算质量比.
解答:混合气体对水蒸气的相对密度为0.4,则混合气体的相对平均分子量为0.4×18=7.2,
运用十字交叉的方法得:
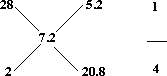
即n(CO):n(H2)=1:4,
则质量之比为:(1×28):(4×2)=7:2.
故选D.
点评:本题考查混合物的计算,题目难度不大,注意本题看似要用到CO、H2与O2反应,CO2、H2O与Na2O2的反应等,实质上题目后面的叙述是干扰.
分析:根据相对分子质量,用十字交叉方法计算两种气体的物质的量比值,进而计算质量比.
解答:混合气体对水蒸气的相对密度为0.4,则混合气体的相对平均分子量为0.4×18=7.2,
运用十字交叉的方法得:

即n(CO):n(H2)=1:4,
则质量之比为:(1×28):(4×2)=7:2.
故选D.
点评:本题考查混合物的计算,题目难度不大,注意本题看似要用到CO、H2与O2反应,CO2、H2O与Na2O2的反应等,实质上题目后面的叙述是干扰.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目