题目内容
哈伯因发明了由N2合成NH3的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下发生反应:N2+3H2 2NH3.下列有关说法正确的是( )
2NH3.下列有关说法正确的是( )A.达到化学平衡时,有2molNH3生成
B.达到化学平衡时,正反应和逆反应的速率均为零
C.达到化学平衡时,N2、H2和NH3的物质的量不再变化
D.达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2
【答案】分析:反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.
A、根据可逆反应的限度分析;
B、化学平衡状态时,正逆反应速率相等,但反应没有停止;
C、化学平衡状态时,各物质的物质的量不再变化;
D、反应达到平衡状态时,各物质的物质的量浓度与反应的初始浓度及转化率有关.
解答:解:A、可逆反应都存在反应的限度,反应物不可能完全转化为生成物,所以不可能有2mol氨气生成,故A错误;
B、化学平衡状态时,正逆反应速率相等,但反应没有停止,所以正反应和逆反应的速率不等于0,故B错误;
C、反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,故C正确;
D、反应达到平衡状态时,各物质的物质的量浓度与反应的初始浓度及转化率有关,则比值不一定为1:3:2,故D错误;
故选C.
点评:本题考查了化学平衡状态的判断,难度不大,注意化学平衡状态时,正逆反应速率相等但不等于0,且必须是同一物质的正逆反应速率相等.
A、根据可逆反应的限度分析;
B、化学平衡状态时,正逆反应速率相等,但反应没有停止;
C、化学平衡状态时,各物质的物质的量不再变化;
D、反应达到平衡状态时,各物质的物质的量浓度与反应的初始浓度及转化率有关.
解答:解:A、可逆反应都存在反应的限度,反应物不可能完全转化为生成物,所以不可能有2mol氨气生成,故A错误;
B、化学平衡状态时,正逆反应速率相等,但反应没有停止,所以正反应和逆反应的速率不等于0,故B错误;
C、反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,故C正确;
D、反应达到平衡状态时,各物质的物质的量浓度与反应的初始浓度及转化率有关,则比值不一定为1:3:2,故D错误;
故选C.
点评:本题考查了化学平衡状态的判断,难度不大,注意化学平衡状态时,正逆反应速率相等但不等于0,且必须是同一物质的正逆反应速率相等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
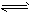 2NH3。下列有关说法正确的是
2NH3。下列有关说法正确的是