题目内容
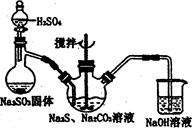
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
(1)试剂X的化学式 。A中制取Cl2的离子方程式 。
(2)试剂Y的名称为 。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | |
| 步骤2:向A试管中滴加BaCl2溶液 | |
| 步骤3: | |
(4)已知,Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为:
。
(1)HCl(1分) MnO2+4H+ Mn2++Cl2↑+2H2O(3分,未配平未没写条件各扣1分)
Mn2++Cl2↑+2H2O(3分,未配平未没写条件各扣1分)
(2)饱和食盐水(饱和氯化钠溶液或水)(,2分)
(3)假设一:NaCl(1分)
假设二:NaCl、Na2CO3 (全对才能得1分,缺任何一种都不给分)实验步骤 预期现象和结论 步骤1:取C中少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 
步骤2:向A试管中滴加BaCl2溶液①若无明显现象,证明固体不含碳酸钠。
②若溶液变浑浊,证明固体中含碳酸钠。
(2分)步骤3:向B试管中滴加过量的稀HNO3溶液,再滴加AgNO3溶液。(2分) 若溶液变浑浊,结合步骤2中①,则假设1成立;结合步骤2中②,则假设2成立。(2分)
(4)Cl2 O +2NaOH =" 2NaClO" +H2O(2分,未配平扣1分)
解析试题分析:(1)实验室常用浓盐酸氧化二氧化锰制取氯气,原理为MnO2+4H+ Mn2++Cl2↑+2H2O(2)碳酸钠与HCl能反应,则除去氯气中混有氯化氢的试剂Y是饱和食盐水;(3)由题意可知,氯由0价升高为+1价,还有部分氯由0价降低到—1价,则所得固体中一定含有NaCl;与潮湿氯气反应的碳酸钠可能过量,则所得固体中可能含有Na2CO3;NaCl、NaHCO3都不能与BaCl2反应,若无白色沉淀生成,说明无Na2CO3;有白色沉淀生成,说明含有Na2CO3;(4)由题意推断,Cl2O +2NaOH =" 2NaClO" +H2O。
Mn2++Cl2↑+2H2O(2)碳酸钠与HCl能反应,则除去氯气中混有氯化氢的试剂Y是饱和食盐水;(3)由题意可知,氯由0价升高为+1价,还有部分氯由0价降低到—1价,则所得固体中一定含有NaCl;与潮湿氯气反应的碳酸钠可能过量,则所得固体中可能含有Na2CO3;NaCl、NaHCO3都不能与BaCl2反应,若无白色沉淀生成,说明无Na2CO3;有白色沉淀生成,说明含有Na2CO3;(4)由题意推断,Cl2O +2NaOH =" 2NaClO" +H2O。
考点:本题考查探究实验。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案海洋约占地球表面积的71%,海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下: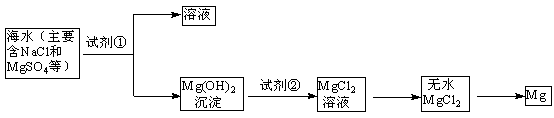
① 试剂①宜选用石灰乳且必须过量,过量的目的是 .
② 镁蒸气宜在 (填序号)气体冷却后得到镁锭
| A.N2 | B.CO2 | C.Ar | D.空气) |

某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):

③A装置中通入a气体时,反应的离子方程式表示为: .
④A装置中通入a气体一段时间后,
停止通入,改通热空气。通入热空气的目的是: .
⑤反应过程中,B装置中产生的两种主要阴离子为 .
⑥C装置的作用是 。
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)乙中反应的离子方程式为 。
(2)乙中生成的气体除N2和CO2外,还有副产物HCl及Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是___________(填字母)
| A.饱和食盐水 | B.饱和NaHCO3溶液 | C.浓NaOH溶液 | D.浓硫酸 |
装有碱石灰的干燥管的作用是 。
(4)戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。若该测得值与实际处理的百分率相比偏低,请简要说明可能的任意一个原因 。
(5)请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂) 。
废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
| | Si | Fe | Cu | Mn | Mg | Cr | Zn | Ti | Al |
| 罐身/% | 0.3 | 0.7 | 0.25 | 0.25 | 1.0~1.5 | | | | 其余 |
| 罐盖/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 4.0~5.0 | | 0.1 | 0.25 | 其余 |
| 拉环/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 3.0~4.0 | 0.1 | 0.25 | 0.1 | 其余 |
为了验证罐身的组成成分,进行了如下实验:
【实验仪器与药品】
仪器:酒精灯、烧杯、试管、试管夹、漏斗、滤纸、铁圈、玻璃棒、砂纸、剪刀
药品:易拉罐、去污粉、NaOH溶液、KSCN溶液、盐酸、镁试剂、高碘酸(H3IO6,弱酸)
【实验方案】
实验预处理:将剪好的易拉罐片用砂纸打磨,除去表面的涂料层,直到光亮后用去污粉清洗干净备用。
【实验过程】分别向试管a、b中加入少量上述易拉罐片,进行如下操作:
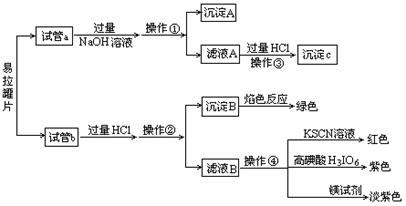
请填写下列空白:
(1)图中操作①②所用到的玻璃仪器有 。
(2)沉淀A的成分为 。
(3)操作③观察到的现象为 ;反应的离子方程式为 、
、 。
(4)若试管a、b中取样相同,则分别加入足量的NaOH溶液、稀盐酸后,相同条件下理论上产生的气体体积V(a) V(b)(填“>”、“<”或“=”)
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验。按右表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象。
| 实验 | P2O5 /g | 95%乙醇量/ mL | 加热方式 |
| 实验1 | 2 | 4 | 酒精灯 |
| 实验2 | 2 | 4 | 水浴70℃ |

实验结果如下:
| 实验 | 实验现象 | ||
| 三颈瓶 | 收集瓶 | 试管 | |
| 实验1 | 酒精加入时,立刻放出大量的白雾,开始有气泡产生,当用酒精灯加热时,气泡加快生成并沸腾,生成粘稠状液体。 | 有无色液体 | 溶液褪色 |
| 实验2 | 酒精加入时,有少量白雾生成,当用水浴加热时,不产生气泡,反应一个小时,反应瓶内生成粘稠状液体 | 有无色液体 | 溶液不褪色 |
根据上述资料,完成下列填空。
(1)写出乙醇制乙烯的化学方程式 。
(2)上图装置中泠凝管的作用是___________,进水口为(填“a”或“b”)______,浓硫酸的作
用是 。
(3)实验1使溴的四氯化碳溶液褪色的物质是___________。
(4)实验2中,水浴加热所需仪器有 、 (加热、夹持仪器、石棉网除外)。
(5)三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式
_____________________,P2O5在实验1中的作用是______________________ 。
(6)根据实验1、2可以推断:
①以P2O5作为催化剂获得乙烯的反应条件是____________
②P2O5与95%乙醇在加热条件下可以发生的有机反应的类型是________反应。
S2C12是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组拟设计实验制备少量的S2C12,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化合价升高,另一部分化合价降低)。加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2C12,反应的化学方程式为:2S+Cl2 S2Cl2。
S2Cl2。
反应涉及的几种物质的熔沸点如下:
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
该小组设计的制备装置如下图(夹持仪器已略去
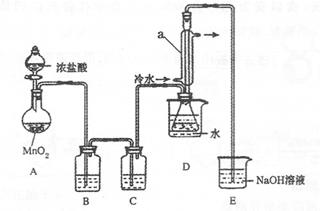
回答下列问题:
(1)连接好实验装置后的第一步实验操作是______。
(2)实验中需要加热的仪器是______。(填写字母)
(3)装置B、C中的试剂分别是______。
(4)装置D中仪器a的作用是______。
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是____________。
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因____________
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气体产生。用离子方程式表示产生该现象的原因____________。