题目内容
已知:体系的自由能变化ΔG=ΔH-TΔS<0时,反应能自发进行。下列反应中,一定不能自发进行的是( )
ΔH=37.301kJ/mol ΔS="184.05" J/(mol·K)
| A.2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.03kJ/mol ΔS="1110" J/(mol·K) |
| B.CO(g)=C(s,石墨)+1/2O2(g) ΔH=110.5kJ/mol ΔS="-89.36" J/(mol·K) |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3kJ/molΔS="-280.1" J/(mol·K) |
| D.NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l) |
B
试题分析:体系的自由能变化ΔG=ΔH-TΔS<0时,反应能自发进行。根据以上已知条件计算ΔH-TΔS判断是否小于零,即可判断反应是否自发。故本题答案选B。
点评:本题考查化学反应进行的方向,题目难度不大,可根据题意进行解答。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
 2C(g)+D(g),在一定温度和容积固定的容器中,下列判断正确的是( )
2C(g)+D(g),在一定温度和容积固定的容器中,下列判断正确的是( ) 2NO+O2,经过一段时间后,测得混合气体中NO2浓度为0.06 mol·Lˉ1,O2的浓度为0.12 mol·Lˉ1,且各物质的浓度不再发生变化,求:(1) NO2的起始浓度?(2) 此时NO2的分解率?
2NO+O2,经过一段时间后,测得混合气体中NO2浓度为0.06 mol·Lˉ1,O2的浓度为0.12 mol·Lˉ1,且各物质的浓度不再发生变化,求:(1) NO2的起始浓度?(2) 此时NO2的分解率? 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( ) 2Z(g)
2Z(g)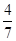 。
。 aX(g)+3Y(g)的平衡常数。
aX(g)+3Y(g)的平衡常数。