题目内容
5.实验室以 为原料,按以下步骤从合成
为原料,按以下步骤从合成  (部分试剂和反应条件已略去).
(部分试剂和反应条件已略去).
回答下列问题:
(1)C的名称是1,2-二溴环己烷,D的结构简式是
 .
.(2)步骤⑦的反应类型是取代反应或水解反应,反应条件是NaOH水溶液、加热.
(3)不考虑反应条件,步骤⑤通过加成反应得到的产物E可能有3种.
(4)写出步骤②“A→B”的化学方程式
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.(5)
 有多种同分异构体,其中既能发生水解反应,又能发生银镜反应的有机物共有8种.
有多种同分异构体,其中既能发生水解反应,又能发生银镜反应的有机物共有8种.
分析  与氢气发生加成反应可生成A为
与氢气发生加成反应可生成A为 ,环己醇在浓硫酸作用下发生消去反应生成B为
,环己醇在浓硫酸作用下发生消去反应生成B为 ,环己烯与溴发生加成反应生成C为
,环己烯与溴发生加成反应生成C为 ,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D(
,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D( ),
), 与溴发生1,4-加成生成E为
与溴发生1,4-加成生成E为 ,
, 与氢气发生加成反应生成F为
与氢气发生加成反应生成F为 ,F在氢氧化钠水溶液、加热条件下发生水解反应生成
,F在氢氧化钠水溶液、加热条件下发生水解反应生成 ,以此来解答.
,以此来解答.
解答 解:(1)C为 ,C的名称是1,2-二溴环己烷,D的结构简式是
,C的名称是1,2-二溴环己烷,D的结构简式是 ,故答案为:1,2-二溴环己烷;
,故答案为:1,2-二溴环己烷; ;
;
(2)步骤⑦的反应类型是取代反应或水解反应,反应条件是NaOH水溶液、加热,故答案为:取代反应或水解反应;NaOH水溶液、加热;
(3)不考虑反应条件,步骤⑤通过加成反应得到的产物E, 可与溴1:1加成有2种产物(1,2加成方式或1,4加成方式),或生成与溴1:2加成有1种产物,则可能有3种,故答案为:3;
可与溴1:1加成有2种产物(1,2加成方式或1,4加成方式),或生成与溴1:2加成有1种产物,则可能有3种,故答案为:3;
(4)步骤②“A→B”的化学方程式为 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O,故答案为:
+H2O,故答案为: $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;
+H2O;
(5) 有多种同分异构体,其中既能发生水解反应,又能发生银镜反应,应为甲酸戊酯,-C5H11有8种,则有机物共有8种,故答案为:8.
有多种同分异构体,其中既能发生水解反应,又能发生银镜反应,应为甲酸戊酯,-C5H11有8种,则有机物共有8种,故答案为:8.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团的变化、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
15.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙醇可被重铬酸钾氧化成乙酸,溶液由橙色变成绿色 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 |
16.下列说法正确的是( )
| A. | 1mol葡萄糖能水解生成2molCH3CH2OH和2molCO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2并加热 | |
| D. | 油脂不是高分子化合物,1mol油脂完全水解生成1mol甘油和3mol高级脂肪酸 |
13.下列反应中,反应物总能量低于生成物总能量,且属于氧化还原反应的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 灼热的炭与CO2反应 | ||
| C. | 铝与稀盐酸 | D. | 铝粉与氧化铁粉末反应 |
20.下列实验事实不能作为实验判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量氨水,判断Mg与Al的金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2气体,判断碳与硅的非金属性强弱 | |
| D. | Br2与I2分别与足量H2反应,判断溴与碘的非金属性强弱 |
17.已知反应物的总能量低于产物的总能量,则反应是( )
| A. | 放热反应 | B. | 吸热反应 | C. | 有催化剂作用 | D. | 无法判断 |
14.如图是滴定管和量筒的两个液面.下列有关读数中正确的是( )
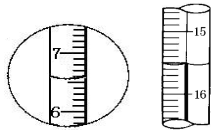

| A. | 左边是量筒读数6.5mL,右边是滴定管读数16.50mL | |
| B. | 左边是量筒读数7.5mL,右边是滴定管读数16.50mL | |
| C. | 左边是量筒读数6.5mL,右边是滴定管读数15.50mL | |
| D. | 左边是量简读数6.5mL,右边是滴定管读数16.50mL |
8.金属钒主要用于冶炼特种钢和在化学工业、炼油工业中作催化剂,被誉为“合金的维生素”.回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如图所示.

(1)粉碎的作用是提高VOSO4(可溶性钒化合物)的浸出率,滤渣可用于制作光导纤维、建筑材料等(填用途).
(2)25时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如表所示:
根据表数据判断,加入氨水调节溶液pH的最佳选择为1.7-1.8;上述过滤操作过程中所需用到的玻璃仪器有漏斗、烧杯、玻璃棒.
(3)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中还原产物和氧化产物的物质的量之比为2:1.
(4)完成并配平氧化过程中的离子方程式:
1ClO3-+6VO2++6H+=6VO3++1Cl-+3H2O.
(5)废钒催化剂中V2O5的质量分数为6%(原料中的所有钒已换算成V2O5).取100g此废钒催化剂按上述流程进行实验,当加入105mL 0.1mol•L-1的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该工业生产中钒的回收率是95.55%.

(1)粉碎的作用是提高VOSO4(可溶性钒化合物)的浸出率,滤渣可用于制作光导纤维、建筑材料等(填用途).
(2)25时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如表所示:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 9.8 | 96.4 | 93.0 | 89.3 |
(3)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中还原产物和氧化产物的物质的量之比为2:1.
(4)完成并配平氧化过程中的离子方程式:
1ClO3-+6VO2++6H+=6VO3++1Cl-+3H2O.
(5)废钒催化剂中V2O5的质量分数为6%(原料中的所有钒已换算成V2O5).取100g此废钒催化剂按上述流程进行实验,当加入105mL 0.1mol•L-1的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该工业生产中钒的回收率是95.55%.

 .
.