题目内容
甲、乙、丙、丁四种物质中,甲、乙、丙均含有某种相同的元素,它们之间具有如下转化关系(反应条件和部分产物已略去):
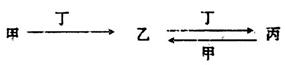
(1)若甲为常见金属单质,甲和丁的稀溶液反应生成无色气体,该气体遇空气变为红棕色。
①检验丙溶液中金属阳离子的试剂为________(填试剂名称)。
②向含n mol丁的稀溶液中加入m mol单质甲,二者恰好完全反应(假设还原产物只有上述无色气体),则n:m可能为__________(填代号)。
a.3:2 b.4:1 c.5:1 d.3:1
③常温下,丁的浓溶液可存放于甲制作的容器中,其原因是________________。
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多。
①鉴别等浓度的乙溶液和丙溶液,可选用的试剂为________(填代号)
a.NaOH溶液 b.CaC12溶液 c.稀硫酸 d.澄清石灰水
②将甲、乙、丙三种溶液混合,向混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如下图所示:
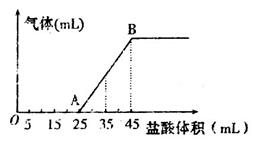
写出OA段所发生反应的离子方程式__________________________,当加入35mL盐酸时,产生气体的体积为22.4mL(标准状况),则盐酸的物质的量浓度为_______。
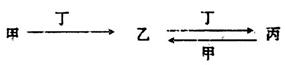
(1)若甲为常见金属单质,甲和丁的稀溶液反应生成无色气体,该气体遇空气变为红棕色。
①检验丙溶液中金属阳离子的试剂为________(填试剂名称)。
②向含n mol丁的稀溶液中加入m mol单质甲,二者恰好完全反应(假设还原产物只有上述无色气体),则n:m可能为__________(填代号)。
a.3:2 b.4:1 c.5:1 d.3:1
③常温下,丁的浓溶液可存放于甲制作的容器中,其原因是________________。
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多。
①鉴别等浓度的乙溶液和丙溶液,可选用的试剂为________(填代号)
a.NaOH溶液 b.CaC12溶液 c.稀硫酸 d.澄清石灰水
②将甲、乙、丙三种溶液混合,向混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如下图所示:

写出OA段所发生反应的离子方程式__________________________,当加入35mL盐酸时,产生气体的体积为22.4mL(标准状况),则盐酸的物质的量浓度为_______。
(1)①硫氰酸钾 ②bd ③常温下,铁在硝酸中钝化
(2)①bc ②OH-+H+=H2O CO32-+H+= HCO3- 0.1mol/L
试题分析:
(1)无色气体遇到空气变成红棕色可知,丁为硝酸,从题目关系图可知,金属甲为Fe。丙溶液中金属阳离子为Fe3+,可用KSCN,检验。n mol丁的稀溶液和m mol单质甲,二者恰好完全反应,设生成xmolNO。用极值法解决,若Fe完全被氧化成Fe3+,则存在x=m,n(NO)+n(NO3-)=n,即n:m=4:1。若Fe完全被氧化成Fe2+,则存在2m=3x,n(NO)+n(NO3-)=n,即n:m=8:3,所以8/3≤n/m≤4,选bd。
③Fe遇到浓硝酸和浓硫酸会发生钝化。
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多。则甲为NaOH,丙为NaHCO3,乙为Na2CO3。NaHCO3和 Na2CO3用氯化钙鉴别时Na2CO3生成沉淀,NaHCO3无现象。用硫酸鉴别时,前者立即产生气体,后者开始无明显现象,滴定一段时间后产生气体。
②将甲、乙、丙三种溶液混合,向混合液中逐滴加入一定浓度的盐酸,H+先与OH-,再与CO32-,生成HCO3-,最后与HCO3-反应生成气体。OA段为H++OH-==H2O,CO32- + H+=HCO3-加入35mL盐酸时,产生气体的体积为22.4mL(标准状况),则n(H2)=0.001mol, H+和HCO3-反应的物质量之比为1:1.则盐酸的物质的量浓度为0.1mol/L。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
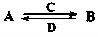 (在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
(在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。