题目内容
15.下列各组粒子中属于同位素的是( )| A. | 12C和13C | B. | H2O和D2O | C. | O2和O3 | D. | 14C和14N |
分析 质子数相同中子数不同的原子互称同位素,互为同位素原子具有以下特征:质子数相同、中子数不同,研究对象为原子.
解答 解:A、12C和13C质子数相同,中子数不同属于同元素的不同原子,为同位素,故A正确;
B、H2O和D2O都是由氢氧元素组成的化合物,结构相同,为同一物质,故B错误;
C、O2和O3都是由氧元素组成的不同单质,为同素异形体,故C错误;
D、14C和14N质子数不相同为,质量数相同,中子数不同,是不同元素的不同核素,不互为同位素,故D错误;
故选A.
点评 本题主要考查了对同位素、同素异形体、同种物质概念的理解,题目难度不大.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
3.下列说法错误的是( )
| A. | 碱金属元素最外层电子数都是1个,化学性质均活泼 | |
| B. | 碱金属元素从上到下随电子层数的增多金属性依次增强 | |
| C. | 碱金属元素的单质都是银白色的,都比较柔软 | |
| D. | 碱金属元素的单质从上到下熔沸点逐渐降低 |
10.下列各组离子在给定条件下能大量共存的是( )
| A. | pH=1的溶液中,NO3-、Na+、I-、Fe2+ | |
| B. | 有CO32-存在的溶液中:Na+、Al3+、Ca2+、Br - | |
| C. | 有SCN-存在的溶液中:NH4+、Ba2+、Fe3+、Cl - | |
| D. | pH=13的无色透明溶液中,K+、Na+、NO3-、CO32- |
20.已知热化学方程式H2 (g)+Br2 (l)→2HBr(g)+72.8kJ.下列叙述正确的是( )
| A. | 该反应放热,无需加热即可反应 | |
| B. | 反应物总能量小于生成物总能量 | |
| C. | 1molH2与1molBr2反应放出72.8kJ热量 | |
| D. | H2 (g)+Br2 (g)→2HBr(g)+Q,Q>72.8kJ |
7.下列叙述正确的是( )
| A. | 乙酸与乙醇互为同系物 | |
| B. | 不同元素的原子构成的分子只含极性共价键 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同质子数相同的同种核素 | |
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
4.下列实验装置或操作不符合实验要求的是( )
| A. |  除去粗盐水中的泥沙 | B. |  灼烧海带 | ||
| C. |  检验蔗糖是否水解 | D. | 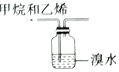 除去甲烷中的乙烯 |
14.原子核外价电子排布式为 3d54s2的元素是( )
| A. | Cr | B. | ds 区元素 | C. | ⅡA族元素 | D. | ⅦB族元素 |

