题目内容
13.实验室用密度为1.25g•mL-1,质量分数为36.5%的浓盐酸配制240mL 0.1mol•L-1的盐酸,请回答下列问题:(1)浓盐酸的物质的量浓度为12.5mol/L.
(2)配制240mL 0.1mol•L-1的盐酸应量取浓盐酸体积2mL,应选用容量瓶的规格250mL.
(3)操作中,将洗涤液都移入容量瓶,其目的是保证溶质全部转入容量瓶中.
(4)实验误差分析:用“偏大”“偏小”或“无影响”填空
①转移到容量瓶的过程中,有少量的溶液溅出偏小.
②用量筒量取浓盐酸时,仰视读数偏大.
③配制前容量瓶中有水滴不影响.
分析 (1)物质的量浓度C=$\frac{1000ρω}{M}$mol/L;
(2)根据稀释前后盐酸的物质的量不变计算需要浓盐酸体积;选取容量瓶规格应该等于或稍大于配制溶液体积;
(3)洗涤液中含有少量的溶质,为保证溶质全部转入容量瓶中,洗涤液要移入容量瓶;
(4)根据C=$\frac{n}{V}$判断误差分析,如果n偏大或V偏小都导致C偏大,如果n偏小或V偏大都导致C偏小.
解答 解:(1)物质的量浓度C=$\frac{1000ρω}{M}$mol/L=$\frac{1000×1.25×36.5%}{36.5}$=12.5mol/L,
故答案为:12.5mol/L;
(2)稀释前后盐酸的物质的量不变,浓盐酸体积=$\frac{0.1mol/L×0.25L}{12.5mol/L}$=2mL;选取容量瓶规格应该等于或稍大于配制溶液体积,实验室没有240mL容量瓶,有250mL容量瓶,所以应该选取250mL容量瓶,故答案为:2;250;
(3)烧杯内壁和玻璃棒上沾有浓盐酸,所以洗涤液中含有少量的溶质,为保证溶质全部转入容量瓶中,洗涤液要移入容量瓶,故答案为:保证溶质全部转入容量瓶中;
(4)根据C=$\frac{n}{V}$判断误差分析,如果n偏大或V偏小都导致C偏大,如果n偏小或V偏大都导致C偏小,
①转移到容量瓶的过程中,有少量的溶液溅出,导致溶质的物质的量偏小,所以配制溶液浓度偏小,故答案为:偏小;
②用量筒量取浓盐酸时,仰视读数浓盐酸体积偏大,则浓盐酸物质的量偏大,所以配制溶液浓度偏大,故答案为:偏大;
③配制前容量瓶中有水滴,溶液体积和溶质物质的量不变,所以不影响配制溶液浓度,故答案为:不影响.
点评 本题考查一定物质的量浓度溶液配制,为高频考点,明确实验原理是解本题关键,知道操作步骤及选取容量瓶和量筒规格的方法,易错点是误差分析.

| A. | 硫化羰的电子式为 | |
| B. | 硫化羰分子中三个原子位于同一直线上 | |
| C. | 硫化羰的沸点比二氧化碳的高 | |
| D. | 硫化羰在O2中完全燃烧后的产物是CO2和SO2 |

| A. | a为正极,b为负极 | |
| B. | 负极反应式为:2H2O+SO2-2e-═SO42-+4H+ | |
| C. | 电子从b极向a极移动 | |
| D. | 生产过程中H+向a电极区域运动 |
| 等级:特级 成份:面料 羊毛80% 绦纶20% 里料 绦纶100% |  |
| 熨烫标准:中温,不超过150℃ |
(2)从此标签中可感觉羊毛、绦纶两种纤维的共同点有不耐高温、有可燃性.
(3)将面料、里料中各抽出一根来点燃,可观察到的现象是羊毛灼烧时有烧焦羽毛的气味,而绦纶无此现象.
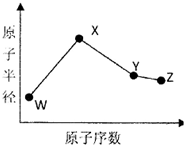 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.(1)Y在周期表中的位置是第三周期第ⅥA族.
(2)用电子式表示化合物X3W的结构
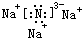 .
.(3)X3W遇水可释放出使酚酞溶液变红的气体A,该反应的化学方程式是Na3N+3H2O=NH3↑+3NaOH.
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则a>b(填“>”或“<”或“=”).
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(6)已知W的单质与气体B在一定条件下可形成气体A,即:W2(g)+3B(g)?2A(g)△H=-92.4kJ•mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mo1/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
②反应在第l0min改变了反应条件,改变的条件可能是ab.
a.更新了催化剂b.升高温度c.增大压强d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是b.
a.更新了催化剂b.升高温度c.增大压强d.减小A的浓度.
| A. | 大理石溶解于醋酸 CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水中加入CuSO4溶液混合 2OH-+Cu2+═Cu(OH)2↓ | |
| C. | NaHSO4溶液和Na2CO3溶液混合 2H++CO32-═CO2↑+H2O | |
| D. | NaHSO4溶液中加入Ba(OH)2═Ba2++SO42-═BaSO4↓ |
| A. | 0.1mol•L-1氨水中,c(OH-)<c(NH4+) | |
| B. | 10mL 0.02mol•L-1HCl溶液与10mL 0.02mol•L-1Ba(OH)2溶液充分混合,c(Cl-)>c(Ba2+)>c(OH-)=c(H+) | |
| C. | 将0.1mol•L-1CH3COONa和0.1mol•L-1NH4Cl等体积混合后的溶液中,c(H+)+c(CH3COOH)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol•L-1某二元弱酸碱性NaHA溶液中,c(H+)+c(H2A)═c(A2-)+c(OH-) |
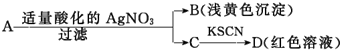
由此得出的结论中,不正确的是( )
| A. | A一定是FeBr3 | B. | B为AgBr | ||
| C. | 滤液C中有Fe3+ | D. | D溶液中存在Fe(SCN)3 |