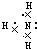题目内容
(Ⅰ)A、B、C和D代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①C的原子序数是A、B的原子序数之和,A、C、D的最外层电子数和为13;
②D的原子序数是C的2倍,D的最高价氧化物对应的水化物是二元强酸.
试根据以上叙述回答:
(1)B单质的电子式为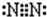
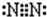 ,画出C元素的原子结构示意图
,画出C元素的原子结构示意图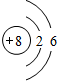
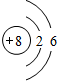 ;
;
(2)下列环境问题与B与C形成的化合物有关的是
A.温室效应 B.光化学烟雾 C.酸雨 D.PM2.5
(3)A、B、C和D四种元素可形成一化合物,其原子个数之比为8:2:4:1.该化合物属于
(Ⅱ)现有下列短周期元素相关性质的数据:
试回答下列问题:
(1)元素⑤在周期表中的位置
A.铁 B.铝 C.金 D.铜
(2)元素④与元素⑦相比较,气态氢化物较稳定的是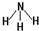
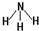 (填结构式);
(填结构式);
(3)元素④形成的+3和+5价的氯化物中,各原子均达到8电子稳定结构的化合物是
①C的原子序数是A、B的原子序数之和,A、C、D的最外层电子数和为13;
②D的原子序数是C的2倍,D的最高价氧化物对应的水化物是二元强酸.
试根据以上叙述回答:
(1)B单质的电子式为
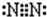
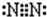
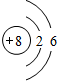
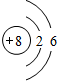
(2)下列环境问题与B与C形成的化合物有关的是
BC
BC
;A.温室效应 B.光化学烟雾 C.酸雨 D.PM2.5
(3)A、B、C和D四种元素可形成一化合物,其原子个数之比为8:2:4:1.该化合物属于
离子晶体
离子晶体
(填晶体类型).(Ⅱ)现有下列短周期元素相关性质的数据:
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
(1)元素⑤在周期表中的位置
第三周期第ⅦA族
第三周期第ⅦA族
;元素②的单质与CO2反应的化学方程式2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
,该单质可通过电解法制得,下列金属中人类最早开发和利用的是
| ||
D
D
;A.铁 B.铝 C.金 D.铜
(2)元素④与元素⑦相比较,气态氢化物较稳定的是
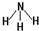
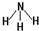
(3)元素④形成的+3和+5价的氯化物中,各原子均达到8电子稳定结构的化合物是
PCl3
PCl3
.(写化学式)分析:(Ⅰ)A、B、C和D代表原子序数依次增大的四种短周期元素.D的最高价氧化物对应的水化物是二元强酸,则D为硫元素;D的原子序数是C的2倍,则C的原子序数为8,故C为氧元素;A、C、D的最外层电子数和为13,则A的最外层电子数为13-6-6=1,A处于ⅠA族,若A为H,则B的原子序数为8-1=7,则B为氮元素,若A为Li,则B的原子序数为8-3=5,则B为硼元素,结合题(2)可知,A为氢元素、B为氮元素,据此解答.
(Ⅱ)①只有-2价,没有正化合价,则为O元素;③⑥都有+1价,处于ⅠA族,原子半径③<⑥,且③的原子半径不是最小,故③为Li元素、⑥为Na元素;②只有+2价,处于ⅡA族,原子半径大于Li原子,故②为Mg元素;④⑦都有+5、-3价,处于ⅤA族,原子半径④>⑦,故④为P元素、⑦为N元素;⑤有+7、-1价,故为Cl元素,据此解答.
(Ⅱ)①只有-2价,没有正化合价,则为O元素;③⑥都有+1价,处于ⅠA族,原子半径③<⑥,且③的原子半径不是最小,故③为Li元素、⑥为Na元素;②只有+2价,处于ⅡA族,原子半径大于Li原子,故②为Mg元素;④⑦都有+5、-3价,处于ⅤA族,原子半径④>⑦,故④为P元素、⑦为N元素;⑤有+7、-1价,故为Cl元素,据此解答.
解答:解:(Ⅰ)A、B、C和D代表原子序数依次增大的四种短周期元素.D的最高价氧化物对应的水化物是二元强酸,则D为硫元素;D的原子序数是C的2倍,则C的原子序数为8,故C为氧元素;A、C、D的最外层电子数和为13,则A的最外层电子数为13-6-6=1,A处于ⅠA族,若A为H,则B的原子序数为8-1=7,则B为氮元素,若A为Li,则B的原子序数为8-3=5,则B为硼元素,结合题(2)可知,A为氢元素、B为氮元素,
(1)B单质为氮气,分子中氮原子之间形成3对共用电子对,故电子式为为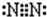 ,
,
O元素质子数为8,核外电子数为8,有2个电子层,最外层电子数为6,故氧原子结构示意图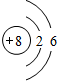 ,
,
故答案为: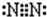 ;
;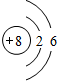 ;
;
(2)氮元素的氧化物可以导致光化学烟雾、酸雨,PM2.5是由粉尘氧气、温室效应由二氧化碳等导致,
故答案为:BC;
(3)A、B、C和D四种元素可形成一化合物,其原子个数之比为8:2:4:1.该化合物是(NH4)2SO4,属于离子晶体,
故答案为:离子晶体;
(Ⅱ)①只有-2价,没有正化合价,则为O元素;③⑥都有+1价,处于ⅠA族,原子半径③<⑥,且③的原子半径不是最小,故③为Li元素、⑥为Na元素;②只有+2价,处于ⅡA族,原子半径大于Li原子,故②为Mg元素;④⑦都有+5、-3价,处于ⅤA族,原子半径④>⑦,故④为P元素、⑦为N元素;⑤有+7、-1价,故为Cl元素,
(1)元素⑤是Cl元素,在周期表中的位置是第三周期第ⅦA族;
元素②是Mg,Mg单质在CO2中燃烧生成碳与氧化镁,反应的化学方程式为:2Mg+CO2
2MgO+C;
人类最早开发和利用的金属,含量较大相对不活泼,故最早开发利用的金属性是Cu;
故答案为:第三周期第ⅦA族;2Mg+CO2
2MgO+C;D;
(2)非金属性N>P,故NH3更稳定,其结构式为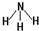 ,
,
故答案为: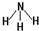 ;
;
(3)元素④为P元素,形成的+3和+5价的氯化物中,PCl3中各原子均达到8电子稳定结构,
故答案为:PCl3.
(1)B单质为氮气,分子中氮原子之间形成3对共用电子对,故电子式为为
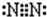 ,
,O元素质子数为8,核外电子数为8,有2个电子层,最外层电子数为6,故氧原子结构示意图
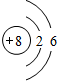 ,
,故答案为:
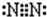 ;
;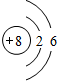 ;
;(2)氮元素的氧化物可以导致光化学烟雾、酸雨,PM2.5是由粉尘氧气、温室效应由二氧化碳等导致,
故答案为:BC;
(3)A、B、C和D四种元素可形成一化合物,其原子个数之比为8:2:4:1.该化合物是(NH4)2SO4,属于离子晶体,
故答案为:离子晶体;
(Ⅱ)①只有-2价,没有正化合价,则为O元素;③⑥都有+1价,处于ⅠA族,原子半径③<⑥,且③的原子半径不是最小,故③为Li元素、⑥为Na元素;②只有+2价,处于ⅡA族,原子半径大于Li原子,故②为Mg元素;④⑦都有+5、-3价,处于ⅤA族,原子半径④>⑦,故④为P元素、⑦为N元素;⑤有+7、-1价,故为Cl元素,
(1)元素⑤是Cl元素,在周期表中的位置是第三周期第ⅦA族;
元素②是Mg,Mg单质在CO2中燃烧生成碳与氧化镁,反应的化学方程式为:2Mg+CO2
| ||
人类最早开发和利用的金属,含量较大相对不活泼,故最早开发利用的金属性是Cu;
故答案为:第三周期第ⅦA族;2Mg+CO2
| ||
(2)非金属性N>P,故NH3更稳定,其结构式为
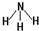 ,
,故答案为:
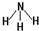 ;
;(3)元素④为P元素,形成的+3和+5价的氯化物中,PCl3中各原子均达到8电子稳定结构,
故答案为:PCl3.
点评:本题考查结构性质位置关系、常用化学用语、元素化合物的性质等,(Ⅱ)中根据化合价与原子半径推断元素是解题关键,注意基础知识的理解掌握.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目