题目内容
(8分)水的电离平衡曲线如图所示。
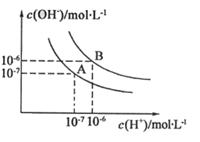
(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从 变化到 。(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的PH=7,则Ba(OH)2和盐酸的体积之比为 。
(3)已知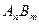 的离子积为
的离子积为 若某温度下
若某温度下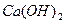 的溶解度为0.74g,设饱和溶液的密度为
的溶解度为0.74g,设饱和溶液的密度为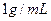 ,其离子积约为 。
,其离子积约为 。
(4)已知25℃时,0.1 L 0.1 mol·L-1的NaA溶液的pH = 10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为 。

(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从 变化到 。(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的PH=7,则Ba(OH)2和盐酸的体积之比为 。
(3)已知
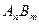 的离子积为
的离子积为 若某温度下
若某温度下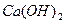 的溶解度为0.74g,设饱和溶液的密度为
的溶解度为0.74g,设饱和溶液的密度为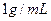 ,其离子积约为 。
,其离子积约为 。(4)已知25℃时,0.1 L 0.1 mol·L-1的NaA溶液的pH = 10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为 。
(1)10-14mol2·L-2(1分);10-12mol2·L-2(1分) (2)2:9 (2分)
(3)4×10-3 mol3·L-3(2分)
(4)[Na+]>[A2-]>[OH-]>[H+](2分)
(3)4×10-3 mol3·L-3(2分)
(4)[Na+]>[A2-]>[OH-]>[H+](2分)
略

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
 O2(g)==CO2(g)△H =-283.0 kJ?mol—1
O2(g)==CO2(g)△H =-283.0 kJ?mol—1