��Ŀ����
����Ŀ��ij�о�С��Ϊ�Ƚ�Al��Fe�Ľ�����ǿ���������ͼ1��ʾ��װ�ã�������ƿ��ʢ�ŵ���100mlϡ���ᣨ��Ӧǰ����Һ����仯���Ժ��Բ��ƣ��� 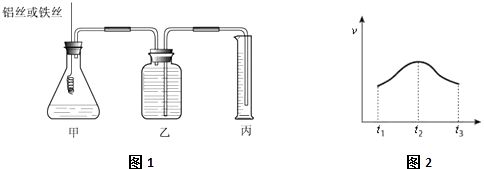
��1����Ҫ�Ƚϲ�������Ŀ��������ַ�����һ���DZȽϲ�����ͬ������������ʱ�䣬��һ���DZȽ���
��2��ʵ���ò�����������ʣ�v����ʱ�䣨t���Ĺ�ϵ��ͼ2��ʾ����t1��t2ʱ���������ӿ�˵���÷�Ӧ��������Ȼ����ȣ���Ӧ��t2��t3ʱ����������������Ҫԭ������
��3���������ͬ�����£��Ѽ���ƿ��ʢ��ϡ����ij�H+Ũ����ͬ��ϡ���ᣬ���ַ�Ӧ���ԭ�������࣬ԭ�����������д��������һ�ּ��ɣ�
���𰸡�
��1����ͬʱ���ڲ������������С
��2�����ȣ�����Ũ�Ȳ��ϼ�С
��3��Cl����ٽ��÷�Ӧ�Ľ��У�����SO42�����Ƹ÷�Ӧ�Ľ��У�
���������⣺��1����v= ![]() ֪����Ӧ����������������ʱ���йأ�����һ���ǹ̶�����Ƚ�ʱ�䣬��һ���ǹ̶�ʱ��Ƚ���������Դ��ǣ���ͬʱ���ڲ������������С����2���÷�Ӧ��һ�����ȵķ�Ӧ�����ŷ�Ӧ�Ľ��У��ų�������Խ�࣬��Һ���¶�Խ�ߣ��¶�Խ�߷�Ӧ����Խ�����ŷ�Ӧ�Ľ��У���Һ�������Ũ�Ȳ��ϼ�С��Ũ��ԽС��Ӧ����ԽС��
֪����Ӧ����������������ʱ���йأ�����һ���ǹ̶�����Ƚ�ʱ�䣬��һ���ǹ̶�ʱ��Ƚ���������Դ��ǣ���ͬʱ���ڲ������������С����2���÷�Ӧ��һ�����ȵķ�Ӧ�����ŷ�Ӧ�Ľ��У��ų�������Խ�࣬��Һ���¶�Խ�ߣ��¶�Խ�߷�Ӧ����Խ�����ŷ�Ӧ�Ľ��У���Һ�������Ũ�Ȳ��ϼ�С��Ũ��ԽС��Ӧ����ԽС��
���Դ��ǣ����ȣ�����Ũ�Ȳ��ϼ�С����3�������ϡ���������ͬ��������H+ �� ϡ����ij�H+Ũ����ͬ��ϡ���ᣬ���ַ�Ӧ���ԭ�������࣬����ΪCl����ٽ��÷�Ӧ�Ľ��У�����SO42�����Ƹ÷�Ӧ�Ľ��У���
���Դ��ǣ�Cl����ٽ��÷�Ӧ�Ľ��У�����SO42�����Ƹ÷�Ӧ�Ľ��У���
�����㾫����ͨ������������ȷ�Ӧ�ͷ��ȷ�Ӧ�����ջ�ѧ�ϰ����������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ����ѧ�ϰѷų������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ�����Խ����⣮

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���������ɻ��Ƚ�ͨ�����ŷŵ�β���к��еĴ���CO��NO �ȴ�����Ⱦ������������������Ҫԭ���о�CO��NO ��ת�����ڻ����ĸ������ش����塣
��1���������뽫CO�����з�Ӧ��ȥ��2CO(g)=2C(s) +O2(g) ��H>0������Ϊ�������ܷ�ʵ�ֲ�˵��������__________________________��
��2���û���̿��ԭ�����Դ�������β���еĵ������ij�о�С����2 L�ĺ����ܱ������м���0.100 mL NO ��2.030 mol�������̿��������Ӧ��C(s)+2NO(g) ![]() N2(g)+CO2(g)���ڲ�ͬ�¶��²��ƽ����ϵ�и����ʵ����ʵ������±���
N2(g)+CO2(g)���ڲ�ͬ�¶��²��ƽ����ϵ�и����ʵ����ʵ������±���
T/�� | n���������̿��/mol | n(NO)/mol | n(N2)/mol | n(CO2)/mol |
200 | 2.000 | 0.040 | 0.030 | 0.030 |
350 | 2.005 | 0.050 | 0.025 | 0.025 |
���÷�Ӧ������ӦΪ___________(��������������������)��Ӧ��
��200��ʱ����Ӧ�ﵽƽ���������������ٳ���0.100 mol NO���ٴδﵽƽ��������NO�İٷֺ�����__________(��������������С������������)��
��������Ӧ��350��ʱ��ƽ�ⳣ��K=_______________��
��3�����ܱ������з�����������,�ﵽƽ��ʱ�����д�ʩ�����NOת���ʵ���___________(����ĸ)��
A.ѡ�ø���Ч�Ĵ��� B.����C(s)����
C.���ͷ�Ӧ��ϵ���¶� D.��С���������
