题目内容
14.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知:①a、c皆能与稀硫酸反应放出气体;②b与d的硝酸盐反应,置换出单质d;③c与强碱溶液反应放出气体;④c、e在冷、浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )| A. | Fe Cu Al Ag Mg | B. | Al Cu Mg Ag Fe | ||
| C. | Mg Cu Al Ag Fe | D. | Mg Ag Al Cu Fe |
分析 排在氢前面的金属能和酸反应产生氢气,活泼的金属能将不活泼的金属从其盐溶液中置换出来,铝和强碱反应放氢气,铁和铝在冷浓硫酸中发生钝化.
解答 解:a、c均能与稀硫酸反应放出气体,说明a、c排在氢前面,c与强碱反应放出气体,c为铝,所以a为镁,c、e在冷浓硫酸中发生钝化,所以e为铁,b与d的硝酸盐反应,置换出单质d,说明b排在d的前面,即b为Cu,d为Ag.
故选C.
点评 本题考查了金属活动性顺序及其应用,完成此题,可以依据金属活动性顺序及其意义进行,题目难度中等.

练习册系列答案
相关题目
4.以下水中平衡体系中分别加入氯化钾固体一定会使其平衡移动的是( )
| A. | Cl2+H2O?HCl+HClO | B. | FeCl3+3KSCN?Fe(SCN)3+3KCI | ||
| C. | MgCl2+2H2O?Mg(OH)2+2HCl | D. | K2CO3+H2O?KHCO3+KOH |
5.海水开发利用的部分过程如图所示.下列说法不正确的是( )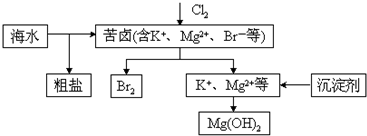

| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 工业生产常选用NaOH作为沉淀剂 | |
| C. | 粗盐可采用除杂和重结晶等过程提纯 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
9.某雨水样品刚采集时测得pH为4.82,放在烧杯中经2小时后,再次测得pH为4.68.以下叙述正确的是( )
| A. | 雨水样品酸性逐渐减小 | |
| B. | 雨水样品酸性没有变化 | |
| C. | 雨水样品pH降低的原因可能是继续吸收空气中的CO2 | |
| D. | 雨水样品中的pH降低的原因可能是H2SO3逐渐被氧气氧化成H2SO4 |
3.下列说法正确的是( )
| A. | 在101kPa时,1mol C与适量O2反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol | |
| B. | 在10lkPa时lmol H2完全燃烧生成液态水放出285.8kJ热量,H2燃烧热为-285.8KJ/mol | |
| C. | 鉴定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| D. | 在稀溶液中:H+(aq)+oH-(aq)═H2O(l)△H=-57.3KJ/mol,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |
4.在500mL 2mol/L KAl(SO4)2的明矾溶液中滴入含有1.5mol溶质的Ba(OH)2溶液,充分反应后铝元素的存在形式是( )
| A. | Al(OH)3和Al3+ | B. | Al(OH)3 | ||
| C. | Al3+、Al(OH)3 和AlO2- | D. | 全部为AlO2- |