题目内容
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
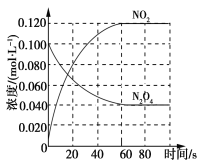
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为____________mol·L-1·s-1;反应的平衡常数K1为________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是______________。
②列式计算温度T时反应的平衡常数K2________________________。
(3)温度T时反应达第一次平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,达到新的平衡后与第一次平衡相对比:颜色____________(填“变深”或“变浅”或“不变”),c(NO2)/c(N2O4)的值_______ (填“增大”、“减小”或“不变”)
【答案】大于 0.0010 0.36 mol·L-1 大于 反应正方向吸热,反应向吸热方向进行,故温度升高 平衡时,c(NO2)=0.120 mol·L-1+0.0020 mol·L-1·s-1×10 s×2=0.16 mol·L-1,c(N2O4)=0.040 mol·L-1-0.0020 mol·L-1·s-1×10 s=0.020 mol·L-1,K2=1.3 mol·L-1 逆反应 变深 减小
【解析】
(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;根据0~60s时段,N2O4浓度变化情况可以求出v(N2O4);根据图像中的数据,可以求出平衡常数K;
(2)①N2O4(g)![]() 2NO2(g),△H>0,升温,平衡右移,c(N2O4) 降低;根据c=v(N2O4)×t,可以求出N2O4气体、NO2气体变化的浓度,然后根据第二次反应达平衡时,求出总c(NO2)、c(N2O4),进而求出K2;
2NO2(g),△H>0,升温,平衡右移,c(N2O4) 降低;根据c=v(N2O4)×t,可以求出N2O4气体、NO2气体变化的浓度,然后根据第二次反应达平衡时,求出总c(NO2)、c(N2O4),进而求出K2;
(3)反应容器的容积减少一半,压强增大,平衡向着气体体积减小的方向移动,判断c(NO2)/c(N2O4)的值变化情况;体积减小造成气体的浓度增大是主要因素,所以混合气体的颜色加深。
(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;在0~60 s时段,N2O4浓度变化为0.1-0.04=0.06mol/L,反应速率v(N2O4)为=0.06/60=0.0010 mol·L-1·s-1;根据图像中的数据可知,反应的平衡常数K=c2(NO2)/c(N2O4)=0.122/0.04=0.36 mol·L-1;
综上所述,本题答案是:大于,0.0010,0.36 mol·L-1。
(2)①c(N2O4) 降低,平衡向正反应方向移动,因为正反应方向吸热,T大于100 ℃;
综上所述,本题答案是:大于;反应正方向吸热,反应向吸热方向进行,故温度升高。
②反应达到平衡时,c(NO2)=0.120 mol·L-1+0.0020 mol·L-1·s-1×10 s×2=0.16 mol·L-1,c(N2O4)=0.040 mol·L-1-0.0020 mol·L-1·s-1×10 s=0.020 mol·L-1,K2=c2(NO2)/c(N2O4)=0.162/0.02≈1.3 mol·L-1 ;
综上所述,本题答案是:平衡时,c(NO2)=0.120 mol·L-1+0.0020 mol·L-1·s-1×10 s×2=0.16 mol·L-1,c(N2O4)=0.040 mol·L-1-0.0020 mol·L-1·s-1×10 s=0.020 mol·L-1,K2=1.3 mol·L-1 。
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,即平衡向逆反应方向移动;由于气体体积减小,造成气体的浓度增大的影响比平衡左移造成NO2(g)浓度减小的影响要大,所以达到新的平衡后与第一次平衡相对比颜色变深;由于平衡左移,c(NO2)减小,c(N2O4)增大,所以c(NO2)/c(N2O4)的值减小;
综上所述,本题答案是:逆反应, 变深,减小。