题目内容
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g) ![]() 2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) △H=___________kJ·mol-1。
2NH3(g) △H=___________kJ·mol-1。
(2)在恒温恒容容积为a L的密闭容器中进行合成氨的反应,起始加入N2 1.0 molH23.0 mol。
①该温度下合成氨反应的平衡常数表达式为__________________;
②经过2min达到化学平衡状态时测得H2的转化率为40%,则平均化学反应速率v(NH3)__________;
③若其它条件不变增大压强,则合成氨反应的化学平衡常数____________(填“变大”、“变小或“不变”);
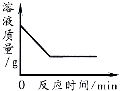
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2 (g)的平衡转化率随X的变化关系。

i .X代表的物理量是________________,
ii.判断L1、L2的大小关系____________ (填“>”“ <”或“ = ”),并简述理由:______________。
【答案】 -92.2 K=![]() 2/5a mol·L-1·min-1 不变 温度 < 该反应为气体分子数减小的反应,当温度一定时,压强越大,平衡转化率越大
2/5a mol·L-1·min-1 不变 温度 < 该反应为气体分子数减小的反应,当温度一定时,压强越大,平衡转化率越大
【解析】试题分析:本题考查盖斯定律的应用,化学反应速率的计算,化学平衡常数表达式的书写以及外界条件对化学平衡常数的影响,化学平衡图像的分析。
(1)将三个反应依次编号:
N2(g)+O2(g) ![]() 2NO(g)△H1=+183 kJ·mol-1(①式)
2NO(g)△H1=+183 kJ·mol-1(①式)
2H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1(②式)
4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1(③式)
应用盖斯定律,将①式+②式![]() 3/2-③式
3/2-③式![]() 1/2,则合成氨的反应N2(g)+3H2(g)
1/2,则合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) △H=183kJ/mol+(-571.6kJ/mol)
2NH3(g) △H=183kJ/mol+(-571.6kJ/mol) ![]() -(-1164.4kJ/mol)
-(-1164.4kJ/mol) ![]() =-92.2kJ·mol-1。
=-92.2kJ·mol-1。
(2)①根据方程式N2(g)+3H2(g)![]() 2NH3(g)可直接写出平衡常数表达式K=
2NH3(g)可直接写出平衡常数表达式K=![]() 。
。
②用三段式, N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
n(起始)(mol) 1 3 0
n(转化)(mol) 0.4 3![]() 0.4=1.2 0.8
0.4=1.2 0.8
n(平衡)(mol) 0.6 1.8 0.8
υ(NH3)=![]() =2/5a mol·L-1·min-1。
=2/5a mol·L-1·min-1。
③化学平衡常数只与温度有关,若其它条件不变增大压强,则合成氨反应的化学平衡常数不变。
④i.若X代表温度,升高温度平衡逆反应方向移动,H2的转化率减小,与图像吻合;若X代表压强,增大压强平衡正反应方向移动,H2的转化率增大,与图像不吻合;则X代表的物理量是温度,L代表压强。
ii.该反应的正反应为气体分子数减小的反应,其他条件不变增大压强平衡正反应方向移动,H2的转化率增大,在横坐标上任取一点(温度相同),作横坐标的垂直线与两曲线相交,L2时H2的转化率大于L1时,则L1![]() L2。
L2。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】下表中实验“操作和现象”与“结论”对应关系正确的一组是( )
操作和现象 | 结论 | |
A | 向纯碱中滴加足量浓盐酸,将产生的气体通入硅酸钠溶液,溶液变浑浊 | 酸性:盐酸>碳酸>硅酸 |
B | 取某溶液少量,加入盐酸酸化的氯化钡溶液, 出现白色沉淀 | 该溶液中一定含有大量 的SO |
C | 用铂丝蘸取少量某溶液进行焰色反应,呈黄色 | 该溶液一定是钠盐溶液 |
D | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO |
A. A B. B C. C D. D