题目内容
(08年北京卷) 下列叙述正确的是 ( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO![]() )>c(NH
)>c(NH![]() )
)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
答案:C
解析:A、根据溶液中电荷守恒知:c(H+)+c(NH4+)=2c(SO42-)+c(OH-),当溶液pH=7时,
c(H+)= c(OH-),那么有:c(NH4+)=2c(SO42-) 则A不正确;B、醋酸是弱酸,不同浓度的醋酸其电离程度不同,当pH相差一个单位时,c1>10c2 B不正确;C、.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合时,醋酸过量,溶液显酸性,滴入石蕊溶液呈红色,C正确;
D、向0.1 mol/L的氨水中加入少量硫酸铵固体,氨水的电离平衡向逆方向移动,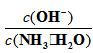 减少。
减少。
高考考点:溶液中离子浓度比较、弱电解质电离平衡及其移动
易错提醒:不能正确理解弱电解质电离的平衡的存在,造成BCD项错误判断
备考提示:解答离子浓度大小比较试题,抓住一个原理、两类平衡、三种守恒进行分析,包括化学平衡移动原理,电离平衡和水解平衡,电荷守恒、物料守恒和质子守恒。其中电荷守恒是指溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数,溶液电中性; 物料守恒是指某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和;质子守恒是指溶液中由水电离出来的H+和OH-总是相等的。质子守恒可由电荷守恒和物料守恒联立推导出来。

练习册系列答案
相关题目
 (08年北京卷)(17分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
(08年北京卷)(17分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。 (4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。