题目内容
完成下列各题
(1)填写下列各题
①微粒2311Na+中的质子数是
②将 A.质子数 B.中子数 C.核外电子数 D.最外层电子数 E.电子层数
填入下列空格内 (只填写序号)
ⅰ.原子种类由
ⅲ.元素的同位素由
ⅴ.元素的原子半径由
ⅶ.元素的化学性质主要由
ⅸ.核电荷数由
(2)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式
①C2H5OH+3O2
2CO2+3H2O:
②Pb+PbO+2H2SO4 2PbSO4+2H2O:
2PbSO4+2H2O:
③6H2O+6CO2
C6H12O6+6O2:
④2Mg+O2
2MgO:
(3)H2O2、KCl、NaOH、Na2O2、HCl、O2中只含离子键的是
(1)填写下列各题
①微粒2311Na+中的质子数是
11
11
,中子数是12
12
,核外电子数是10
10
.②将 A.质子数 B.中子数 C.核外电子数 D.最外层电子数 E.电子层数
填入下列空格内 (只填写序号)
ⅰ.原子种类由
AB
AB
决定ⅱ.元素种类由A
A
决定ⅲ.元素的同位素由
B
B
决定ⅳ.同位素的相对原子质量由AB
AB
决定ⅴ.元素的原子半径由
ACE
ACE
决定ⅵ.元素的化合价主要由D
D
决定ⅶ.元素的化学性质主要由
D
D
决定ⅷ.价电子数通常是指D
D
ⅸ.核电荷数由
A
A
决定(2)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式
①C2H5OH+3O2
| ||
化学能转化为热能
化学能转化为热能
②Pb+PbO+2H2SO4
 2PbSO4+2H2O:
2PbSO4+2H2O:放电时化学能转化为电能;充电时电能转化为化学能
放电时化学能转化为电能;充电时电能转化为化学能
③6H2O+6CO2
| ||
| 叶绿体 |
太阳能转化为化学能(或生物质能);
太阳能转化为化学能(或生物质能);
④2Mg+O2
| ||
化学能转化为光能和热能
化学能转化为光能和热能
(3)H2O2、KCl、NaOH、Na2O2、HCl、O2中只含离子键的是
KCl
KCl
;只含极性键的是HCl
HCl
;只含非极性键的是O2
O2
;既含离子键又含极性键的是NaOH
NaOH
,既含离子键又含非极性键的是Na2O2
Na2O2
,既有极性键又有非极性键的是H2O2
H2O2
.分析:(1)①根据元素符号周围数字代表的含义分析;
②ⅰ.根据原子种类与质子数、中子数的关系分析;根据元素的定义判断;
ⅲ根据同位素的定义分析;
ⅳ.根据相对原子质量与质子数、中子数的关系分析;
ⅴ.根据原子半径与与质子数、中子数的关系分析;
ⅵ.根据元素的化合价与最外层电子数的关系判断;
ⅶ.根据元素的化学性质与最外层电子数的关系判断;
ⅷ.根据价电子数的定义判断;
ⅸ.根据核电荷数与质子数的关系分析;
(2)根据化学反应与能量变化的关系分析;
(3)根据物质中微粒间存在的相互作用力分析.
②ⅰ.根据原子种类与质子数、中子数的关系分析;根据元素的定义判断;
ⅲ根据同位素的定义分析;
ⅳ.根据相对原子质量与质子数、中子数的关系分析;
ⅴ.根据原子半径与与质子数、中子数的关系分析;
ⅵ.根据元素的化合价与最外层电子数的关系判断;
ⅶ.根据元素的化学性质与最外层电子数的关系判断;
ⅷ.根据价电子数的定义判断;
ⅸ.根据核电荷数与质子数的关系分析;
(2)根据化学反应与能量变化的关系分析;
(3)根据物质中微粒间存在的相互作用力分析.
解答:解:(1)①元素符号左下角表示质子数,左上角表示质量数,质量数-质子数=中子数,阳离子的核外电子数=核内质子数-电荷数.
故答案为:11;12;10;
②ⅰ.原子不同,质量数不同,所以与质子数、中子数有关,故选AB;
ⅱ元素是具有相同质子数的一类原子的总称,所以元素种类由质子数决定,故选:A;
ⅲ同位素是质子数相同中子数不同的同一元素的不同原子,所以由中子数决定,故选B;
ⅳ.原子的质量主要集中在原子核上,所以同位素的相对原子质量由质子数、中子数决定,故选AB;
ⅴ.元素的原子半径由质子数、核外电子数、电子层数决定,故选ACE;
ⅵ.元素发生化学反应时,得失电子与最外层电子数有关,故选D;.
ⅶ.元素发生化学反应时,得失电子与最外层电子数有关,所以其化学性质与最外层电子数有关,故选D;
ⅷ.价电子数通常是指最外层电子数,故选D;
ⅸ.质子带电,中子不带电,所以核电荷数与质子数有关,故选A;
(2)(1)该反应燃烧过程中放出热量,故答案为:化学能转化为热能;
(2)该反应反应时,放电时化学能转化为电能;充电时,电能转化为化学能,故答案为:放电时化学能转化为电能;充电时电能转化为化学能
(3)太阳能通过叶绿体转化为化学物质,所以是太阳能转化为化学能,故答案为:太阳能转化为化学能(或生物质能);
(4)该反应反应时发光、放热,所以是化学能转化为光能和热能,故答案为:化学能转化为光能和热能;
(3)H2O2分子中原子间存在的化学键是极性键、非极性键;
KCl离子间存在的化学键是离子键;
NaOH 离子间存在的化学键是离子键,氢氧原子间存在的化学键是极性键;
Na2O2 离子间存在的化学键是离子键,氧原子间存在的化学键是非极性键;
HCl中原子间存在的化学键是极性键;
O2分子中原子间存在的化学键是非极性键;
故答案为:KCl;HCl;O2;NaOH;Na2O2;H2O2.
故答案为:11;12;10;
②ⅰ.原子不同,质量数不同,所以与质子数、中子数有关,故选AB;
ⅱ元素是具有相同质子数的一类原子的总称,所以元素种类由质子数决定,故选:A;
ⅲ同位素是质子数相同中子数不同的同一元素的不同原子,所以由中子数决定,故选B;
ⅳ.原子的质量主要集中在原子核上,所以同位素的相对原子质量由质子数、中子数决定,故选AB;
ⅴ.元素的原子半径由质子数、核外电子数、电子层数决定,故选ACE;
ⅵ.元素发生化学反应时,得失电子与最外层电子数有关,故选D;.
ⅶ.元素发生化学反应时,得失电子与最外层电子数有关,所以其化学性质与最外层电子数有关,故选D;
ⅷ.价电子数通常是指最外层电子数,故选D;
ⅸ.质子带电,中子不带电,所以核电荷数与质子数有关,故选A;
(2)(1)该反应燃烧过程中放出热量,故答案为:化学能转化为热能;
(2)该反应反应时,放电时化学能转化为电能;充电时,电能转化为化学能,故答案为:放电时化学能转化为电能;充电时电能转化为化学能
(3)太阳能通过叶绿体转化为化学物质,所以是太阳能转化为化学能,故答案为:太阳能转化为化学能(或生物质能);
(4)该反应反应时发光、放热,所以是化学能转化为光能和热能,故答案为:化学能转化为光能和热能;
(3)H2O2分子中原子间存在的化学键是极性键、非极性键;
KCl离子间存在的化学键是离子键;
NaOH 离子间存在的化学键是离子键,氢氧原子间存在的化学键是极性键;
Na2O2 离子间存在的化学键是离子键,氧原子间存在的化学键是非极性键;
HCl中原子间存在的化学键是极性键;
O2分子中原子间存在的化学键是非极性键;
故答案为:KCl;HCl;O2;NaOH;Na2O2;H2O2.
点评:本题考查了原子的构成、化学反应与能量变化、化学键等知识点,属于基础知识,要注重基础知识的掌握与积累.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目






 完成下列各题
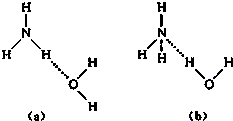
完成下列各题 NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是