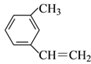
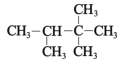
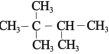
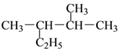题目内容
【题目】下表是元素周期表的一部分,字母a~j代表10种常见的短周期元素,请用相应的化学用语或者化学符号回答下列问题。

(1)d在周期表中的位置是___。与g同主族的下一周期的元素的原子序数为___。
(2)b的一种同位素含有8个中子,可用于考古时测定文物的年代,则该同位素的原子符号为___。
(3)在e、f、i、j四种元素中,简单离子半径最大的是___(填离子符号)。
(4)e、f、g三种元素的最高价氧化物对应的水化物中碱性最强的是___(填化学式)。
(5)c、i、j分别形成的简单气态氢化物中,最不稳定的是___(填化学式),还原性最强的是___(填化学式)。
(6)元素a与e可以形成离子化合物ea,请用电子式表示出其形成过程___。
【答案】第二周期VIIA族 31 14C(或![]() C) S2- NaOH H2S H2S
C) S2- NaOH H2S H2S ![]()
【解析】
由元素在周期表的位置可知:a是H,b是C,c是O,d是F,e是Na,f是Mg,g是Al,h是P,i是S,j是Cl,由以上分析可知:
(1)d是F元素,在周期表位置是第二周期VIIA族,g是Al元素,它的原子序数为13,同主族的下一周期的元素的原子序数为13+18=31;
答案为第二周期VIIA族,31。
(2)b为C元素,它的质子数为6,它的一种同位素含有8个中子,质量数为6+8=14,可用于考古时测定文物的年代,则该同位数的符号为14C(或![]() );
);
答案为14C(或![]() )。
)。
(3)在Na、Mg、S、Cl四种元素中,简单离子S2-和Cl-具有相同的电子层结构,离子半径随着核电荷的递增而减小,则离子半径S2->Cl-,同理Na+和Mg2+也具有相同的电子层结构,离子半径随着核电荷的递增而减小,则离子半径Na+>Mg2+,由于S2-、Cl-电子层有三层,Na+、Mg2+电子层是二层,所以离子半径S2->Cl->Na+>Mg2+,离子半径最大的是S2-;
答案为S2-。
(4)Na、Mg、Al三种元素处于同一周期,从左至右,金属性依次减弱,其最高价氧化物对应的水化物中碱性依次减弱,故碱性NaOH>Mg(OH)2>Al(OH)3,碱性最强的为NaOH;
答案为NaOH。
(5)O、S、Cl三种元素,非金属性O>S(同主族性质递变),Cl>S(同周期性质递变),则S的非金属性在三种元素中最弱,因而氢化物最不稳定,其还原性最强;
答案为H2S,H2S。
(6)元素H与Na可以形成离子化合物NaH,用电子式表示出其形成过程为:![]() ;
;
答案为![]() 。
。

 优学名师名题系列答案
优学名师名题系列答案【题目】 某固体混合物,仅含有以下阴、阳离子中的某几种(不考虑水的电离):
阳离子 | K+、Ba2+、Ag+、Mg2+ |
阴离子 | Cl-、SO32-、CO32-、AlO2-、MnO4- |
为了判断该混合物的组成,现依次进行如下实验,根据实验现象,回答下列问题:
(1)取该固体混合物,加水后固体完全溶解得到无色溶液,用pH试纸测得溶液的pH为12。则混合物组成中肯定不存在的离子是________。
(2)向(1)所得溶液中滴加盐酸,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。则肯定存在的离子是________,可以排除的离子是________。
(3)取以上实验的上层澄清液,滴加AgNO3溶液,有白色沉淀生成。你认为还有哪些离子尚待检验:________(填离子符号),请你对尚待检验的离子提出合理的检验方法(要求写出具体的步骤、现象与结论):____________________________________