��Ŀ����
A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ����ԭ�Ӱ뾶��С��ԭ�ӣ�BԪ�ص�����������Ӧˮ���������⻯������һ����X��D��Aͬ���壬����Eͬ���ڣ�EԪ�ص��������������������������3/4��A��B��D��E������Ԫ�أ�ÿһ����CԪ�ض����γ�Ԫ�ص�ԭ�Ӹ����Ȳ���ͬ�������ֻ������ش��������⣺
��1��C��E��Ԫ����Ƚϣ��ǽ����Խ�ǿ���� ����Ԫ�����ƣ���������֤�ý��۵��� ����д��ţ���
A���Ƚ�������Ԫ�ص���̬�⻯��ķе�
B���Ƚ�������Ԫ�ص�ԭ�ӵĵ��Ӳ���
C���Ƚ�������Ԫ�ص���̬�⻯����ȶ���
D���Ƚ�������Ԫ�صĵ������⻯�ϵ�����
��2��C��D��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1:1�Ļ�������C��E��Ԫ���γɵ����ֻ����ﶼ�ܷ�Ӧ������һ�ֹ�ͬ�IJ��д����������Ӧ�Ļ�ѧ����ʽ��
�� ��
��3��A��B��C��E����Ԫ�ؿ��γ�������ʽ�Σ�������ʽ�����Ӧ�����ӷ���ʽΪ ��X��ˮ��Һ�� �ԣ�ԭ���ǣ������ӷ���ʽ��ʾ�� ��
��4��A��C��E����γɼס��������������Ǿ�Ϊ��һ��˫ԭ�������ӣ��Ҽ���18�����ӣ�����10�����ӣ�������ҷ�Ӧ�����ӷ���ʽΪ ��
��5��DԪ�ص���̬�⻯�����ͼ��������ܷ�Ӧ����D�ĵ��ʣ��÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ ��
��6�����ڻ���ƽ�����װ��Һ̬B2A4��Һ̬A2C2����֪0.4mol.Һ̬B2A4������Һ̬A2C2��Ӧ��������̬B2����̬A2C���ų�256.6kJ����������д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��B2A4�ֳ�Ϊ�£���һ�ֿ�ȼ��Һ�壬��һ����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20%�D30%��KOH��Һ���õ�طŵ�ʱ�ĵ缫��ӦʽΪ������ ������ ��
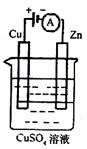
��ͼ��һ���绯ѧ����ʾ��ͼ��
1��пƬ�Ϸ����ĵ缫��ӦʽΪ ��
2������ʹ����һ����ȼ�ϵ����Ϊ�������еĵ�Դ��ͭƬ�������仯Ϊ128g������һ����ȼ�ϵ�����������ı�״���µĿ��� L����������������������Ϊ20%����
��1������1�֣� BCD
��2��Na2O2+SO2 Na2SO4�� 2Na2O2+2SO3 2Na2SO4+O2����
��3��HSO3�D+H+ SO2��+H2O���
NH4++H2O ![]() NH3?H2O+H+
NH3?H2O+H+
��4��HS�D+OH�D S2�D+H2O
��5��2:1��1�֣�
��6����N2H4��l��+2H2O��l��=N2��g��+4H2O��g������H=��641.5kJ?mol�D1
��O2+2H2O+4e�D 4OH�D N2H4+4OH�D��4e�D 4H2O+N2��
Cu2++2e�D Cu��1�֣� 112

 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�





 Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ�������
Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ�������