题目内容
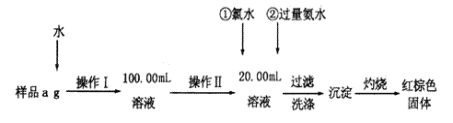
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2)为原料,生产Fe3O4的部分工艺流程如下:

下列说法错误的是
A. 用NaOH溶液吸收焙烧过程产生的SO2有利于保护环境和资源再利用
B. 从高硫铝土矿中可制得Al、Fe的化合物
C. 向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由AlO转化为Al3+
D. FeS2与Fe2O3混合后在无氧条件下焙烧的目的是生成Fe3O4和SO2
【答案】C
【解析】
本题主要考查工艺流程分析。根据流程矿粉焙烧时FeS2与O2反应生成Fe2O3和SO2,“碱浸”时Al2O3、SiO2转化为溶于水的NaAlO2、Na2SiO3;Fe2O3和FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2;由此作答即可。
A.SO2为有毒气体,不能直接排放至空气中,可用NaOH溶液吸收焙烧过程产生的SO2,有利于保护环境和资源再利用,正确;
B.高硫铝土矿中含有大量Al和Fe元素,可通过适当的操作得到Al和Fe的化合物,正确;
C.由上述分析可知,滤液中含有NaAlO2、Na2SiO3,通入过量的CO2后,生成Al(OH)3和H2SiO3,错误;
D. Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,反应的化学方程式为FeS2+16Fe2O3![]() 11Fe3O4+2SO2↑,正确。答案选C。
11Fe3O4+2SO2↑,正确。答案选C。

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案
相关题目