题目内容
(12分)氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化。
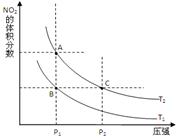
(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC(同上)。
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC(同上)。
(2)在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 。
②100℃时,反应2NO2(g) N2O4(g)的平衡常数K的值为 。
N2O4(g)的平衡常数K的值为 。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是 mol/L
④计算③中条件下达到平衡后混合气体的平均相对分子质量为 。(结果保留小数点后一位)
(1)对反应N2O4(g)
 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC(同上)。
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC(同上)。
(2)在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②100℃时,反应2NO2(g)
 N2O4(g)的平衡常数K的值为 。
N2O4(g)的平衡常数K的值为 。 ③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是 mol/L
④计算③中条件下达到平衡后混合气体的平均相对分子质量为 。(结果保留小数点后一位)
(1)< ; < 。(2)① 0.0025 mol·L-1·s-1(单位1分)。② 2.78 。 ③ 0.1 。④ 57.5 。
N2O4(g) 2NO2(g) △H>0 P1时,T1 T2二氧化氮的分数增加,向正向进行,正向是吸热反应,所以温度升高T1<T2.从反应开始直至20s时,v(NO2)=" 0.0025" mol·L-1·s-1
2NO2(g) △H>0 P1时,T1 T2二氧化氮的分数增加,向正向进行,正向是吸热反应,所以温度升高T1<T2.从反应开始直至20s时,v(NO2)=" 0.0025" mol·L-1·s-1
N2O4(g) 2NO2(g)平衡常数K=0.122/0.04
2NO2(g)平衡常数K=0.122/0.04
0mol 0.4mol
0.08mol 0.16mol
0.08mol 0.24mol
 2NO2(g) △H>0 P1时,T1 T2二氧化氮的分数增加,向正向进行,正向是吸热反应,所以温度升高T1<T2.从反应开始直至20s时,v(NO2)=" 0.0025" mol·L-1·s-1
2NO2(g) △H>0 P1时,T1 T2二氧化氮的分数增加,向正向进行,正向是吸热反应,所以温度升高T1<T2.从反应开始直至20s时,v(NO2)=" 0.0025" mol·L-1·s-1N2O4(g)
 2NO2(g)平衡常数K=0.122/0.04
2NO2(g)平衡常数K=0.122/0.040mol 0.4mol
0.08mol 0.16mol
0.08mol 0.24mol

练习册系列答案
相关题目
 2Z △H< 0达到平衡时,若升高温度则能使
2Z △H< 0达到平衡时,若升高温度则能使 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和体积不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和体积不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( ) 2NH3(g);△H<0
2NH3(g);△H<0 2SO2(g)+O2(g);△H>0
2SO2(g)+O2(g);△H>0 2HI(g)的平衡常数K="O.25" ,该温度下在甲、乙、丙三个恒容密闭容器中充入H2 (g)、 I2 (g),起始浓度如下表所示:
2HI(g)的平衡常数K="O.25" ,该温度下在甲、乙、丙三个恒容密闭容器中充入H2 (g)、 I2 (g),起始浓度如下表所示: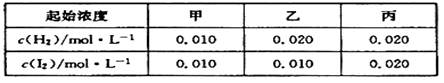
 C(g) +D(g) 发生过程中的能量变化如图,△H表示反应的焓变。下列说法正确的是( )
C(g) +D(g) 发生过程中的能量变化如图,△H表示反应的焓变。下列说法正确的是( )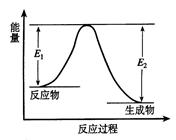
 2NH3现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
2NH3现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生,下列有关说法正确的是( ) 2NO2(g),不能说明该反应已达到平衡状态的是( )
2NO2(g),不能说明该反应已达到平衡状态的是( ) 
 109
109
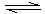 NH3的△H 0(填“>”、“<”或“无法判断”
NH3的△H 0(填“>”、“<”或“无法判断” ,请简要说明理由 ;
,请简要说明理由 ;