题目内容
【题目】汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)(1)4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填序号);
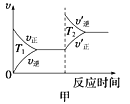
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。
CO2(g)+H2(g) ΔH<0。
820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为___________
②平衡时,甲容器中CO的转化率是 。比较下列容器中CO的转化率:乙 甲;丙 甲(填“>”、“=”或“<”)。
③丙容器中,通过改变温度,使CO的平衡转化率增大,则温度 (填“升高”或“降低”),平衡常数K (填“增大”、“减小”或“不变”)。
【答案】(1)乙(2)①K=c(CO2)c(H2)/c(CO)c(H2O) ②50% > = ③降低 增大
【解析】
试题分析:(1)③甲:升高温度,化学平衡逆向移动,化学反应速率会迅速增大,会离开原来的速率点,故甲错误;乙:升高温度,化学反应速率会迅速增大,所以T2时先达到化学平衡状态,并且化学平衡逆向移动,二氧化氮的转化率减小,故乙正确;丙:对于反应:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g),T不变,增大压强,平衡正向移动,一氧化碳的体积分数会减小,故丙错误,答案选乙;
4CO2(g)+N2(g),T不变,增大压强,平衡正向移动,一氧化碳的体积分数会减小,故丙错误,答案选乙;
(2)①化学平衡常数K=各个生成物平衡浓度系数次方的乘积/各个反应物平衡浓度系数次方的乘积=c(CO2)c(H2)/c(CO)c(H2O);
②设甲容器中CO的变化量是x,
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始量(mol) 0.1 0.1 0 0
变化量(mol)x x x x
平衡量(mol)0.1-x 0.1-x x x
则x×x/(0.1x)×(0.1x)=1,解得x=0.5,所以甲容器中CO的转化率为50%;根据投料情况知道,乙相当于在甲的基础上增加了水蒸气的投料,所以会使得一氧化碳的转化率增大,丙装置投料是甲装置的2倍,对于化学反应前后系数和不变的反应来说,建立的平衡是等效的,所以两种情况下,转化率是相等的;
③丙容器中,通过改变温度,使CO的平衡转化率增大,由于正反应是放热反应,则温度降低,平衡常数K增大。
