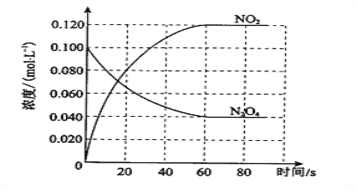
题目内容
【题目】下列属于弱电解质的是
A. BaSO4 B. CH3COOH C. C2H5OH D. Cu
【答案】B
【解析】
电解质与非电解质均是化合物,能够完全电离的电解质是强电解质,只能部分电离的电解质是弱电解质。
A项、溶于水的硫酸钡完全电离,属于强电解质,故A错误;
B项、醋酸溶于水部分电离,属于弱电解质,故B正确;
C项、C2H5OH属于非电解质,故C错误;
D项、铜是单质,既不是电解质也不是非电解质,故D错误。
故选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】下列各项中的物质,能满足如图中阴影部分关系的
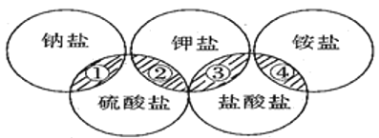
选项 | ① | ② | ③ | ④ |
A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
B | NaCl | K2SO4 | KCl | NH4Cl |
C | Na2SO4 | K2SO4 | KCl | NH4Cl |
D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
A. A B. B C. C D. D