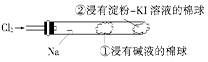��Ŀ����
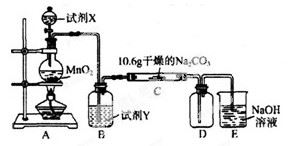
ij��ѧ��ȤС������ʵ����̽�����������ʼ�ģ�ҵ��ȡƯ�ۣ����������װ�ý���ʵ�飨ʵ������ȡ�����ķ�ӦΪMnO2 + 4 HCI(Ũ�� MnCl2 + C12��+ 2 H2O����
MnCl2 + C12��+ 2 H2O����
�밴Ҫ��ش��������⣺
��1�����۵⻯����Һ�й۲쵽��������_________����Ӧ�����ӷ���ʽ____________��
��2�����������ɫ��������ɫ��ʪ�����ɫ������ɫ�������ʢ��________�������ƣ���
��3��C12��ʯ���鷴Ӧ��ȡƯ�۵Ļ�ѧ����ʽΪ___________________��
��4������ȤС����8.7g MnO2��������Ũ�����Ʊ��������������������Ƶñ�״���µ�Cl2______________L��
 MnCl2 + C12��+ 2 H2O����
MnCl2 + C12��+ 2 H2O����
�밴Ҫ��ش��������⣺
��1�����۵⻯����Һ�й۲쵽��������_________����Ӧ�����ӷ���ʽ____________��
��2�����������ɫ��������ɫ��ʪ�����ɫ������ɫ�������ʢ��________�������ƣ���
��3��C12��ʯ���鷴Ӧ��ȡƯ�۵Ļ�ѧ����ʽΪ___________________��
��4������ȤС����8.7g MnO2��������Ũ�����Ʊ��������������������Ƶñ�״���µ�Cl2______________L��
��1����Һ����ɫ Cl2+2I-=2Cl-+I2
��2��Ũ����
��3��2Cl2+2Ca(OH)2��CaCl2+Ca(ClO)2+2H2O
��4��2.24
��2��Ũ����
��3��2Cl2+2Ca(OH)2��CaCl2+Ca(ClO)2+2H2O
��4��2.24
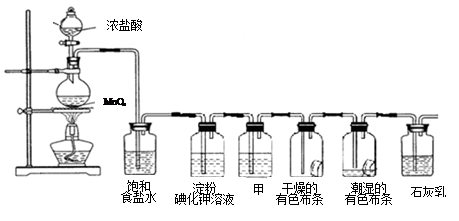
�����������1��MnO2��Ũ�����ϼ��ȷ�����Ӧ��ȡCl2,����HCl�лӷ��ԣ�ʵ����Cl2�к�������HCl���ñ���NaCl��Һ����ȥHCl�����п��Լ���Cl2�����ġ�����Cl2�������ԣ�����KI������Ӧ��Cl2+2KI=2KCl+I2��I2�����۱���ɫ����Ӧ�����ӷ���ʽΪCl2+2I-=2Cl-+I2����2�����������ɫ��������ɫ��ʪ�����ɫ������ɫ�������ʢ��Ũ���ᡣ��3��C12��ʯ���鷴Ӧ��ȡƯ�۵Ļ�ѧ����ʽΪ2Cl2+2Ca(OH)2��CaCl2+Ca(ClO)2+2H2O����4��n(MnO2)=8.7g��87g/mol="0.1mol." ����HCl���������Էų���������MnO2���������ݷ���ʽMnO2 + 4 HCI(Ũ��
 MnCl2 + C12��+ 2 H2O�ɵ÷ų���C12�����ʵ���Ϊ0.1mol.�ڱ�״���£������Ϊ2.24L��2��ʵ�����Ʒ����йص����ʡ������й�����Ħ������ļ����֪ʶ��
MnCl2 + C12��+ 2 H2O�ɵ÷ų���C12�����ʵ���Ϊ0.1mol.�ڱ�״���£������Ϊ2.24L��2��ʵ�����Ʒ����йص����ʡ������й�����Ħ������ļ����֪ʶ��
��ϰ��ϵ�д�
�����Ŀ