题目内容
1.A、B、C、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子的化合物;B与Z的最外层电子数之比为2:3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题:
(1)Z的原子结构示意图为
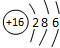 ;元素C在周期表中的位置是第二周期第VA族,A与B所形成的化合物BA4的电子式为
;元素C在周期表中的位置是第二周期第VA族,A与B所形成的化合物BA4的电子式为 ;
;(2)化合物Y2X2属于离子化合物,含有的化学键是离子键、共价键;该化合物中阳离子与阴离子的个数比2:1;
(3)化合物A2X和A2Z中,沸点较高的是H2O(填化学式);
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物反应可以生成Z单质和一种10电子化合物,反应的化学方程式为H2O2+H2S=S↓+2H2O
(5)用电子式表示化合物Y2X的形成过程
 .
.
分析 A、B、C、X、Y和Z是原子序数依次递增的短周期元素,X与Z同主族,结合原子序数可知,X处于第二周期,Z处于第三周期,A与Y同主族,而Y的原子序数大于X,则Y只能处于第三周期,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,Y2X2为Na2O2,X为O元素,Y为Na,可推知Z为S元素;A与B和A与X均可形成10个电子的化合物,则A为H元素;B与Z的最外层电子数之比为2:3,则B元素的最外层电子数为4,而B、C均处于第二周期,故B为碳元素,C的原子序数介于碳、氧之间,则C为N元素,据此解答.
解答 解:A、B、C、X、Y和Z是原子序数依次递增的短周期元素,X与Z同主族,结合原子序数可知,X处于第二周期,Z处于第三周期,A与Y同主族,而Y的原子序数大于X,则Y只能处于第三周期,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,Y2X2为Na2O2,X为O元素,Y为Na,可推知Z为S元素;A与B和A与X均可形成10个电子的化合物,则A为H元素;B与Z的最外层电子数之比为2:3,则B元素的最外层电子数为4,而B、C均处于第二周期,故B为碳元素,C的原子序数介于碳、氧之间,则C为N元素.
(1)Z为S元素,原子结构示意图为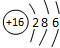 ,C为N元素,在周期表中的位置是:第二周期第VA族,A与B所形成的化合物CH4的电子式为
,C为N元素,在周期表中的位置是:第二周期第VA族,A与B所形成的化合物CH4的电子式为 ,
,
故答案为: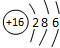 ;第二周期第VA族;
;第二周期第VA族; ;
;
(2)化合物Na2O2属于离子化合物,含有的化学键是:离子键、共价键;该化合物中阳离子与阴离子的个数比2:1,
故答案为:离子键、共价键;2:1;
(3)H2O分子之间存在氢键,H2S分子之间不能形成氢键,沸点较高的是H2O,
故答案为:H2O;
(4)H与O和H与S均能形成18个电子的化合物,此两种化合物反应可以生成S单质和一种10电子化合物,应是H2O2与H2S反应生成S与H2O,反应的化学方程式为:H2O2+H2S=S↓+2H2O,
故答案为:H2O2+H2S=S↓+2H2O;
(5)用电子式表示化合物Na2O的形成过程: ,
,
故答案为: .
.
点评 本题考查位置结构性质的关系及应用,推断元素是解题关键,较好的考查学生分析推理能力,注意用电子式表示物质或化学键的形成,学习中注重基础知识的积累,难度中等.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 用大理石与稀盐酸取二氧化碳 | |
| B. | 用Mn02与浓盐酸制取氯气 | |
| C. | 用浓硫酸和浓盐酸混合制取少量HCl | |
| D. | 用H202溶液和Mn02制取氧气 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.10 | 0.20 | 0.20 |
| c(CO2)/mol/L | 0.10 | 0.10 | 0.20 |
| A. | 平衡时,乙中CO2的转化率等于50% | |
| B. | 当反应平衡时,丙中c(CO2)是甲中的2倍 | |
| C. | 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应 | |
| D. | 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/LCO2,到达平衡时c (CO)与乙不同 |
| 容器编号 | 温度 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化 | 达到平衡所需时间 | |
| N2O4 | NO2 | ||||
| ① | T1 | 2 | 0 | 吸热22.8kJ | 2min |
| ② | T2 | 0 | 4 | 放热Q(Q>0)kJ | … |
| ③ | T3 | 3 | 1 | … | … |
| A. | 容器①中,从起始到平衡时,用NO2表示的平均反应速率v(NO2)为0.2mol(L•min) | |
| B. | 若容器①在恒温恒压下达平衡,该条件下的平衡常数等于0.2 | |
| C. | 若Q<34.2kJ,则T1>T2 | |
| D. | 容器③在达平衡前,v(正)<v(逆) |
| A. | 1.2 mol•L-1 | B. | 1.6 mol•L-1 | C. | 2.4 mol•L-1 | D. | 3.6 mol•L-1 |
| A. | 黑磷与白磷互为同分异构体 | B. | 黑磷能导电 | ||
| C. | 白磷转化为黑磷是物理变化 | D. | 黑磷能在空气中自燃 |
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(3)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$E.$\frac{cC{H}_{3}CO{O}^{-}•c{H}^{+}}{cC{H}_{3}COOH}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCE.
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则相同条件下HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
| A. | 混合液中c(SO${\;}_{4}^{2-}$)为0.04 mol•L-1 | |
| B. | 原Al2(SO4)3溶液中c(Al3+)与100 mL 0.02 mol•L-1 Al(NO3)3中c(Al3+)相等 | |
| C. | 混合后的溶液中含有0.003 mol Na+ | |
| D. | 混合后溶液中c(Na+)为0.02 mol•L-1 |
