题目内容
下列叙述中正确的是( )
| A、离子晶体中肯定不含非极性共价键 |
| B、原子晶体的熔点肯定高于其它晶体 |
| C、由分子组成的物质其熔点一定较低 |
| D、原子晶体中除非极性共价键外不存在其它类型的化学键 |
考点:晶体的类型与物质熔点、硬度、导电性等的关系,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A.过氧化钠含有离子键和非极性键;
B.氧化镁的熔点高于二氧化硅;
C.分子晶体熔化时克服分子间作用力;
D.如原子晶体为化合物,含有极性键.
B.氧化镁的熔点高于二氧化硅;
C.分子晶体熔化时克服分子间作用力;
D.如原子晶体为化合物,含有极性键.
解答:
解:A.离子晶体可以含有非极性共价键,例如过氧化钠,故A错误;
B.不一定,原子晶体总体来说熔点比较高,但是有些离子晶体的熔点高于某些原子晶体,如氧化镁的熔点比二氧化硅高,故B错误;
C.因为是分子晶体,熔化的时候克服的是较弱的分子间作用力,所以分子晶体的熔点较低,故C正确;
D.二氧化硅中,含有的是极性共价键,故D错误.
故选C.
B.不一定,原子晶体总体来说熔点比较高,但是有些离子晶体的熔点高于某些原子晶体,如氧化镁的熔点比二氧化硅高,故B错误;
C.因为是分子晶体,熔化的时候克服的是较弱的分子间作用力,所以分子晶体的熔点较低,故C正确;
D.二氧化硅中,含有的是极性共价键,故D错误.
故选C.
点评:本题考查常见晶体类型以及熔点高低的比较,为高频考点,侧重于学生的分析能力的考查,答题时注意能举出反例,难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
下列反应中属于加成反应的是( )
| A、乙炔通入酸性高锰酸钾溶液中,溶液褪色 |
| B、苯滴入溴水中,振荡后溴水层接近无色 |
| C、将裂化获得的汽油滴入溴水中,溴水褪色 |
| D、甲烷和氯气混合后,放置在光亮的地方,混合气体颜色逐渐变浅 |
肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.下列说法中,不正确的是( )


| A、该电池放电时,通入肼的一极为负极 |
| B、电池每释放1mol N2转移的电子数为4NA |
| C、通入空气的一极的电极反应式是:O2+2H2O+4e-=4OH- |
| D、电池工作一段时间后,电解质溶液的pH将不变 |
下列不能使淀粉碘化钾试纸变蓝的物质是( )
| A、碘水 | B、溴水 |
| C、氯水 | D、溴化钠溶液 |
代表有机物中几种同系物的相对分子质量的一组数字是( )
| A、16、32、48、64 |
| B、2、16、30、44、58 |
| C、16、17、18、19 |
| D、46、60、74、88、102 |
下列物质中属于非电解质,但放入水中后所得溶液导电性明显增强的是( )
| A、金属钠 | B、三氧化硫 |
| C、氯化钠 | D、乙醇 |
单质与浓硝酸混合,出现的情况依次为:①反应生成相应的硝酸盐;②反应生成最高价含氧酸;③常温下单质发生钝化;④不发生反应.符合上述要求的单质组是( )
| A、Cu、C、Zn、Au |
| B、Si、P、Al、Pt |
| C、Fe、C、Pt、Hg |
| D、Cu、S、Fe、Au |
下列各项叙述中,正确的是( )
| A、C6H5CH2CH2OH与C6H5OH互为同系物 |
| B、H2O与D2O互为同素异形体 |
C、 与 与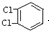 互为同分异构体 互为同分异构体 |
| D、等物质的量的乙醇和乙烯完全燃烧时所需氧气的质量相等 |