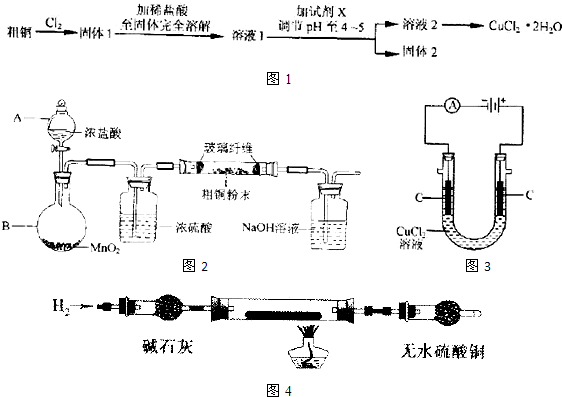
题目内容
铜有Cu2O(红色)和CuO(黑色)两种常见的氧化物。某高中化学兴趣小组的同学对初中课本实验的结论“H2与CuO反应生成红色物质Cu”提出质疑,认为生成的红色物质不一定就是铜。为了确定该红色物质的成分,该兴趣小组开展了以下研究。
(一)提出猜想:红色物质可能是铜、氧化亚铜或两者的混合物。
(二)查阅资料:①Cu2+在酸性条件下能发生自身氧化还原反应(Cu2O+2H+ =Cu2++Cu+H2O);②在空气中灼烧Cu2O能生成CuO。
(三)制备红色物质:方法同初中课本
(四)红色物质成分的探究:
甲同学设计了以下三种探究方案:
方案I:取该红色物质溶于足量稀硝酸中,观察溶液颜色的变化。
方案II:取该红色物质溶于足量稀硫酸中,观察现象。
方案III:称得干燥的坩埚的质量为m1g,取红色物质置于坩埚中再称得质量为m2g。
然后将红色物质在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量,反复多次直到质量不变,称得最后质量为m3g,比较m1、m2、m3。
回答下列问题:
(1)方案I是否合理 (填“合理”或“不合理”)。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。 。
(2)方案II中,若观察不到明显现象,则可知红色物质为 ;若观察到溶液变为蓝色,则可知红色物质为 。
(3)方案III中,如果m1、m2、m3的关系符合m3= ,可确认红色物质为Cu2O。
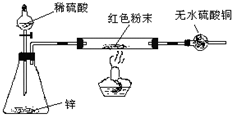
(4)乙同学利用下列装置设计了第四种探究方案:
各装置接口的正确连接顺序是( )接( )( )接( )( )接( );试剂X可选用 ;要测定红色物质的成分,最少需要测定的物理量是 (填序号)。
①通入氢气的体积 ②反应前,红色物质+反应管的总质量
③实验前干燥管的质量 ④完全反应后,红色物质+反应管的总质量
⑤反应管的质量 ⑥实验后干燥管的质量
(1)不合理;因为Cu和Cu2O与稀HNO3反应后溶液均呈蓝色
(2)Cu;Cu2O或者Cu和Cu2O的混合物
(3)![]()
(4)(a)接(d)(e)接(f)(g)接(b)(f,g可以互换);
浓H2SO4;②④⑤

I.有关资料:铜的化合物颜色性质如下
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 | 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
(1)提出假设.
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为
(2)实验验证
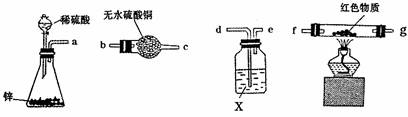
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物.
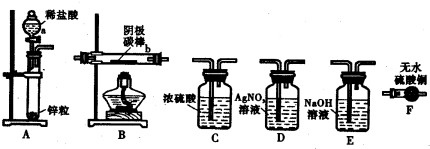
①实验前,检查装置A气密性的方法是
②实验时,各装置从左至右的连接顺序为A→
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象①碳棒上的红色物质是否有Cu2O
②装置
③写出装置b中发生反应的化学方程式
(4)问题讨论
①电解CuCl2溶液后的阴极上发生的反应为:
②实验过程中,若装置b中的空气没有排净就开始加热,可能对实验造成的影响是
Ⅰ、有关资料
铜的化合物颜色性质如下:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(CuO) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
(1)提出假设:
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证:
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物
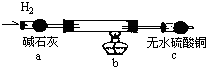
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
①碳棒上的红色物质是否有Cu2O
②在c装置后将气体通入
③写出装置b中发生反应的化学方程式:
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e-=Cu和
②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入