题目内容
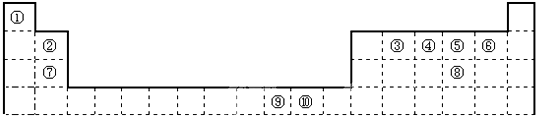
12.有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20;只有C、E是金属元素;A和E元素原子的最外层电子都只有一个;B和D 元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍;C元素原子的最外层电子数是D元素原子最外层电子数的一半.由此可知:(1)C在元素周期表中的位置是第三周期第ⅢA族.
(2)D元素最高价氧化物对应水化物的分子式为H2SO4,E元素形成的最高价氧化物对应水化物的化学键类型离子键、共价键.
(3)D与E形成的化合物属于离子化合物(填“离子化合物”或“共价化合物”).
(4)写出C与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20,B和D元素原子的最外层电子数相同,二者处于同主族,且B原子L层电子数是K层电子数的3倍,则B原子L层电子数为6,故B为氧元素、D为硫元素;C、E是金属元素,A和E原子的最外层电子都只有一个,二者处于ⅠA族,结合原子序数可知,E为K元素、A为氢元素;C元素原子的最外层电子数是D元素原子最外层电子数的一半,最外层电子数为3,结合原子序数可知C为Al,据此解答.
解答 解:A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20,B和D元素原子的最外层电子数相同,二者处于同主族,且B原子L层电子数是K层电子数的3倍,则B原子L层电子数为6,故B为氧元素、D为硫元素;C、E是金属元素,A和E原子的最外层电子都只有一个,二者处于ⅠA族,结合原子序数可知,E为K元素、A为氢元素;C元素原子的最外层电子数是D元素原子最外层电子数的一半,最外层电子数为3,结合原子序数可知C为Al.
(1)由上述分析可知,C为Al,处于第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)D为硫元素,最高价氧化物对应水化物的分子式为H2SO4,E为K元素,最高价氧化物对应水化物为KOH,含有离子键、共价键,
故答案为:H2SO4;离子键、共价键;
(3)D与E形成的化合物为K2S,由钾离子与硫离子构成,属于离子化合物,
故答案为:离子化合物;
(4)Al与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查结构性质位置关系,推断元素是解答的关键,题目难度不大,旨在考查学生对基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.已知某反应的能量变化如图所示,下列说法正确的是( )


| A. | 该反应为放热反应 | |
| B. | 该反应可为Ba(OH)2•8H2O与NH4Cl晶体的反应 | |
| C. | 该反应可为甲烷在氧气中的燃烧反应 | |
| D. | 该反应只有在加热条件下才能进行 |
3.下列各化合物的命名中正确的是( )
| A. | 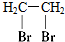 二溴乙烷 二溴乙烷 | B. | 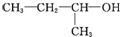 1-甲基-1-丙醇 1-甲基-1-丙醇 | ||
| C. |  4一甲基-戊烷 4一甲基-戊烷 | D. | 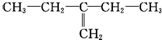 2-乙基-1-丁烯 2-乙基-1-丁烯 |
7.下列各组物质中,只用溴水就能鉴别的一组是( )
| A. | 己烯、苯、苯酚 | B. | 四氯化碳、硝基苯、乙醇 | ||
| C. | 乙酸、乙醇、苯酚 | D. | 乙烷、乙烯、乙炔 |
17.下列关于有机化合物的叙述中不正确的是( )
| A. | 丙烷跟甲烷一样能与氯气发生取代反应 | |
| B. | 1 mol乙酸与乙醇在一定条件下发生酯化反应,可生成1 mol乙酸乙酯 | |
| C. | CH2Cl2是纯净物说明甲烷是四面体结构而不是正方形结构 | |
| D. | 溴水既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 |
4.常温下,pH为3的FeCl3溶液,pH为11的Na2CO3溶液和pH为3的盐酸中由水电离出来的H+的浓度分别为:C1、C2、C3,它们之间的关系是( )
| A. | C1<C2<C3 | B. | C1=C2>C3 | C. | C1>C2>C3 | D. | 无法判断 |
1.下列各组物质中,不管它们以何种比例混合,只要总物质的量一定,充分燃烧后生成的二氧化碳的量和水的量均不变的是( )
| A. | 乙炔和苯 | B. | 乙醇和丙醇 | ||
| C. | 乙醇和乙醚(C2H5OC2H5) | D. | 乙醇和乙烷 |
2.已知短周期元素(1~18号元素)的离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径:A>B>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 单质的还原性:A>B>D>C | D. | 离子半径:C>D>B>A |