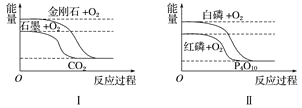
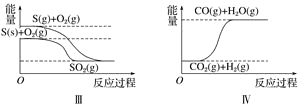
题目内容
【题目】雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在密闭容器中发生该反应时
2CO2(g)+N2(g)。在密闭容器中发生该反应时
,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

据此判断:
①该反应的温度T2____ T1 (填“>”或“<”)。
②在T1温度下,0~2 s内的平均反应速率v(N2)=___________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若增大催化剂的表面积,则CO转化率__ (填“增大”“减小”或“不变”)。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____(填字母)。

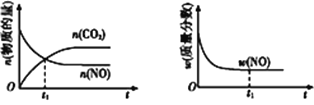
a b c
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ/mol
2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol
N2O4(g) ΔH=-56.9 kJ/mol
写出CH4催化还原N2O4(g)生成N2、CO2和H2O(g)的热化学方程式:_________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极a、b表面发生的电极反应式分别为a:____________________,
b:___________________________________。

【答案】<0.05mol/(L·s)不变cH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1kJ·mol-12H2O-4e-=O2↑+4H+2CO2+4H++4e-=2HCOOH
【解析】
(1)①先拐先平,温度高,由图1可知,温度T1先到达平衡,因此该反应的温度T2<T1;综上所述,本题答案是:<。
②由图可知,T1温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.2mol/L,故v(CO2)=0.2/2=0.1mol/(L·s),速率之比等于化学计量数之比,故v(N2)=1/2v(CO2)=1/2×0.1mol/(L·s)=0.05mol/(L·s);综上所述,本题答案是:0.05mol/(L·s)。
③接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,一氧化碳的转化率不变;综上所述,本题答案是:不变。
④a、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故b错误;
c、NO的质量分数为定值,t1时刻处于平衡状态,故c正确;
综上所述,本题选c。
(2)①已知:Ⅰ、CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=﹣867kJ/mol,Ⅱ、2NO2(g)![]() N2O4(g)△H2=﹣56.9kJ/mol;根据盖斯定律,Ⅰ﹣Ⅱ得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=﹣867kJ/mol﹣(﹣56.9kJ/mol)=﹣810.1kJ/mol,即CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),△H=﹣810.1kJ/mol;综上所述,本题答案是:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1kJ·mol-1。
N2O4(g)△H2=﹣56.9kJ/mol;根据盖斯定律,Ⅰ﹣Ⅱ得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=﹣867kJ/mol﹣(﹣56.9kJ/mol)=﹣810.1kJ/mol,即CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),△H=﹣810.1kJ/mol;综上所述,本题答案是:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1kJ·mol-1。
②由图可知,左室投入水,生成氧气与氢离子,电极a表面发生氧化反应,为负极,电极反应式为2H2O﹣4e﹣═O2↑+4H+,右室通入二氧化碳,酸性条件下生成HCOOH,电极b表面发生还原反应,为正极,电极反应式为2CO2+4e﹣+4H+═2HCOOH;综上所述,本题答案是:2H2O﹣4e﹣═O2↑+4H+;2CO2+4H++4e﹣=2HCOOH。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案