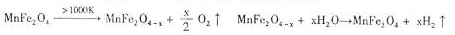题目内容
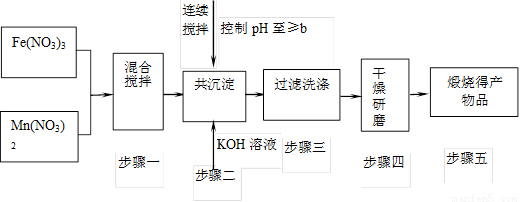
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:
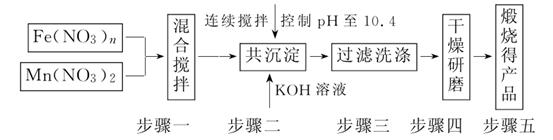
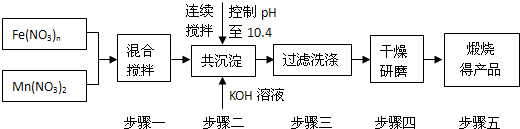
(1)原料Fe(NO3)n中n=____________,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为__________。
(2)步骤二中“连续搅拌”的目的是____________;步骤三中洗涤干净的标准是______________________。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4![]() MnFe2O4-x+
MnFe2O4-x+![]() O2↑
O2↑
MnFe2O4-x+xH2O―→MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
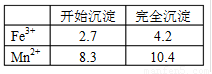
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为__________。
②该热化学循环制氢的优点有(答两点即可)__________________________________________________。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是______________________________。
解析:(1)Mn为+2价,则MnFe2O4中Fe的化合价为+3价,则Fe(NO3)n中n=3,且二者比例为2∶1。
(2)连续搅拌是为了让二者充分反应,洗涤至中性保证产物纯净。
(3)①x=0.8时,铁的总价态为(4-0.8)×2-2=4.4,设1 mol MnFe2O4-0.8中含Fe2+、Fe3+物质的量分别为x mol、y mol,则有:![]()
解得:x=1.6,y=0.4,则1 mol MnFe2O4-0.8中含Fe2+的物质的量为1.6 mol,则Fe2+占的百分率为![]() ×100%=80%。
×100%=80%。
②③由流程可看出其优点,改进方法可从流程简洁方面考虑。
答案:(1)3 2∶1 (2)充分反应、沉淀完全 洗涤至流出液呈中性 (3)①80%
②过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等(答两点即可)
③寻找合适的催化剂,使MnFe2O4分解温度降低或分解温度更低的氧化物(其他合理答案亦可)

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
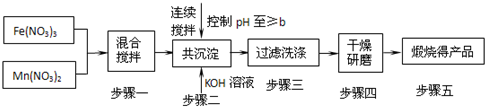

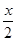 O2(g);△H1
O2(g);△H1