题目内容
(15分)
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。
Ⅰ.MnFe2O4的制备:
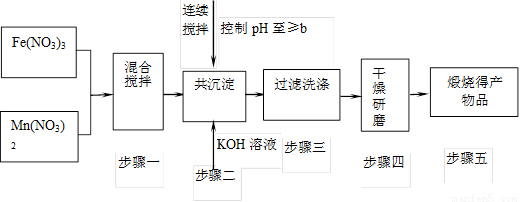

 已知Fe3+、Mn2+沉淀的pH为下表所示。
已知Fe3+、Mn2+沉淀的pH为下表所示。
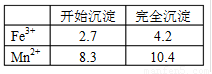
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2
 的物质的量之比应为
。
的物质的量之比应为
。
(2)步骤二中b的值为 。
 (3)步骤三中洗涤干净的标准是
。
(3)步骤三中洗涤干净的标准是
。
Ⅱ.用MnFe2O4热化学循环制氢:
 MnFe2O4(s)→MnFe2O(4-x)(s) +
MnFe2O4(s)→MnFe2O(4-x)(s) + 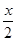 O2(g);△H1
O2(g);△H1
MnFe2O(4-x)(s)+ xH2O →MnFe2O4(s) + xH2(g);△H2
 请回答下列问题:
请回答下列问题:
(4) 若MnFe2O(4-x)中x=0.8,则MnFe2O(4-x)中Fe2+在全部铁元素中的质量分数为 。
 (5)该热化学循环制氢的优点有
(填序号)。
(5)该热化学循环制氢的优点有
(填序号)。
A.过程简单、无污染 B.物料可循环使用  C.氧气和氢气在不同步骤生成,安全且易分离
C.氧气和氢气在不同步骤生成,安全且易分离
(6)已知 2H2(g)+O2(g)= 2H2O(g);△H3
 则:△H3与△H1、△H2的关系为△H3= 。
则:△H3与△H1、△H2的关系为△H3= 。
共15分
(1)2∶1 (2)10.4 (3)最后的洗涤液呈中性 (各2分)
(4)80% (5)A、B、C
(6)-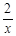 (△H1 +△H2)(各3分)
(△H1 +△H2)(各3分)
【解析】

 优等生题库系列答案
优等生题库系列答案32.目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为民用燃料。管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4。它们的燃烧反应如下:
2CO+O2![]() 2CO2 2H2+O2
2CO2 2H2+O2![]() 2H2O
2H2O
CH4+2O2![]() CO2+2H2O
CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是 。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是 进风口(填增大或减小),如不作改进可能产生的不良结果是 。
管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
| 乙烷 | 丙烷 | 丁烷 |
熔点(℃) | -183.3 | -189.7 | -138.4 |
沸点(℃) | -88.6 | -42.1 | -0.5 |
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是
。
33.随着人类能量消耗的迅速增加,如何有效地提高能量利用率是人类所面临的一项重要任务。下图是上海“明珠线”某轻轨车站的设计方案,与站台连接的轨道有一个小的坡度。请你从提高能量利用效率的角度,分析这种设计的优点。

34.为了解决能源危机,人类还需要进一步开发可再生能源,包括太阳能、风能、潮汐能、生物质能等各类能源。生物质包括农、林、畜牧业的废弃物、藻类等,蕴藏着相当惊人的能量。生物质能是绿色植物通过光合作用的光反应阶段,将太阳能转变为 贮于 和NADPH中。通过暗反应阶段最终将能量贮藏在 中。利用生物质能还可以极大地减少CO2的排放,有利于解决能源消耗带来的 效应问题。