��Ŀ����
����Ŀ��������(GaN)����Ϊ�������뵼����ϣ���Ӧ��ȡ����ͻ���ԵĽ�չ��һ������������GaN�Ĺ�����ͼ��

(1)����ת����ʱGaת��ΪGaN�Ļ�ѧ����ʽ��_____��
(2)���������Ŀ����_____�������������а����IJ�����_____��
ijѧУ��ѧ��ȤС����ʵ��������ͼװ��ģ���Ʊ������أ�

(3)����X�е��Լ���_____������Y��������_____��װ��G��������_____��
(4)����ǰ����ͨ��һ��ʱ���H2��ԭ����_____��
(5)ȡijGaN��Ʒm������������NaOH��Һ��������Ӧ GaN+OH��+H2O![]() GaO2-+NH3������H3BO2��Һ��������NH3��ȫ���գ��ζ�����Һʱ����Ũ��Ϊc mol/L������V mL������Ʒ�Ĵ�����_____������֪��NH3+H3BO3=NH3H3BO3��NH3H3BO3+HCl=NH4Cl+H3BO3��
GaO2-+NH3������H3BO2��Һ��������NH3��ȫ���գ��ζ�����Һʱ����Ũ��Ϊc mol/L������V mL������Ʒ�Ĵ�����_____������֪��NH3+H3BO3=NH3H3BO3��NH3H3BO3+HCl=NH4Cl+H3BO3��
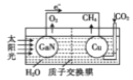
(6)��ѧ���õ����ز�����ͭ��װ����ͼ��ʾ���˹����ϵͳ���ɹ���ʵ������CO2��H2O�ϳ�CH4����д��ͭ���ĵ缫��Ӧʽ_____��
���𰸡�2Ga+2NH3![]() 2GaN+3H2 ��ȥGaN�л��е�����Ni ���ˡ�ϴ�ӡ����� Ũ��ˮ ���θ���� ��ȥδ��Ӧ���NH3����ֹ��Ⱦ���� �ų�װ���еĿ���������������ط�Ӧ���ﲻ������ֹ������������ը
2GaN+3H2 ��ȥGaN�л��е�����Ni ���ˡ�ϴ�ӡ����� Ũ��ˮ ���θ���� ��ȥδ��Ӧ���NH3����ֹ��Ⱦ���� �ų�װ���еĿ���������������ط�Ӧ���ﲻ������ֹ������������ը ![]() % CO2+8e-+8H+=CH4+2H2O
% CO2+8e-+8H+=CH4+2H2O
��������
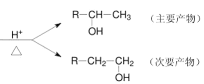
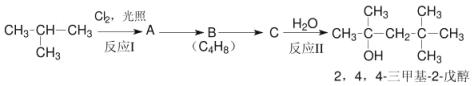
�����̿�֪����ת��ʱGa��NH3�ڸ��������·�Ӧ����GaN��H2��������ɳ�ȥNi�����˷����GaN�����Ʊ�װ�ÿ�֪��A��Zn��ϡ���ᷴӦ����H2������H2��װ���ڵĿ����ų���ֹ������������B��Ũ����ɸ���H2��XΪ��ˮ��C���Ʊ�NH3��YΪ��ʯ�ҿɸ���NH3��E��NH3��Ga��Ӧ���Ʊ�GaN��F�ɷ�ֹ������G��ϡ���������β�����Դ������
(1)Ga��NH3�ڸ��������·�Ӧ����GaN��H2����Ӧ����ʽΪ2Ga+2NH3![]() 2GaN+3H2��
2GaN+3H2��
(2)���������Ŀ���dz�ȥGaN�л��е�����Ni�������������а����IJ����ǹ��ˡ�ϴ�ӡ����
(3)����X�е��Լ���Ũ��ˮ������ˮ����ʢ��CaO����ƿ�з�����Ӧ��ȡNH3������Y�����������θ���ܣ�ʢ�м�ʯ�ң������Ǹ��ﰱ����װ��G�����������չ����İ�������ֹ��Ⱦ������
(4)����ǰ����ͨ��һ��ʱ���H2��ԭ�����ų���������ֹ������������ͬʱ��ֹ������������������ȼ��ը��
(5)��GaN+OH-+H2O![]() GaO2-+NH3����NH3+H3BO3=NH3H3BO3��NH3H3BO3+HCl=NH4Cl+H3BO3����֪n(GaN)=n(HCl)������Ʒ�Ĵ�����
GaO2-+NH3����NH3+H3BO3=NH3H3BO3��NH3H3BO3+HCl=NH4Cl+H3BO3����֪n(GaN)=n(HCl)������Ʒ�Ĵ�����![]() ��100%=
��100%=![]() %��
%��
(6)����ͼʾ��֪��Cu��������������CO2�õ��Ӻ�H+��Ӧ����CH4����������ĵ缫��ӦʽΪ��CO2+8e-+8H+=CH4+2H2O��

 ��������ϵ�д�
��������ϵ�д�����Ŀ���о�������ʴ�ͷ�����ԭ��������ʵ���壮

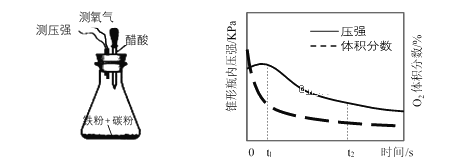
��1����ͼΪ�˽̰�̲���̽��������������ʴ��װ�ã�ij��ȤС�鰴װ�����飬������Һ��������������Ϊ����������ع۲쵽Һ���������������д�ʩ�����________������ţ�
A���ô����������Թ��ڿ���
B���þƾ��Ƽ����Թ�����¶�
C���������������ۺ�̿�ۻ�Ϸ�ĩ
D�����ɸ�ϸ�ĵ��ܣ�ˮ�еμӺ�īˮ
��2��Ϊ̽��������ʴʵ��a��b�����������ķ�Ӧ������ʦ��������ʵ�飬֤���������绯ѧ��ʴ������ɱ���հף�
ʵ����� | ʵ������ | ʵ����� |
��.��NaCl��Һ�еμ�2~3�η�ָ̪ʾ�� | a�㸽����Һ���ֺ�ɫ | a��缫��ӦΪ_______________ |
��.Ȼ���ٵμ�2~3�����軯����Һ | b����Χ������ɫ���� | b��缫��ӦΪ_______________ �����Ļ�ѧʽΪ______________ |
��3������ʦ��Ϊ��ͨ��b��������֤���������˵绯ѧ��ʴ�������������ʵ�飬��ʵ�鼸���Ӻ�ļ�¼���£�
ʵ�� | �ι� | ���� |
1.0 mol��L-1NaCl��Һ | 0.5 molL��1K3[Fe��CN��6]��Һ | ��Ƭ�������������ɫ���� |
����ʵ�������K3[Fe��CN��6]����________��
��4������ʦ�������װ���о������Ի����и�ʴ����Ҫ��ʽ���ⶨ��ƿ����ѹ�Ϳ��������������������ʱ��仯��ͼ����ͼ�пɷ�����t1~t2֮����Ҫ����_________��ʴ�������������⣩
��5�����������ۻ��γɱ���Ĥ��һ�ֵ绯ѧ������������Fe����������H2SO4��Һ�У�һ��������Fe�����γ�����Fe3O4����Ĥ����д���������缫��Ӧʽ_________��