题目内容
【题目】把5.1g镁铝合金的粉末放入过量的300mL 2molL﹣1盐酸中,得到5.6L H2(标准状况下).试计算:
(1)该合金中铝和镁的物质的量之比.
(2)在反应后的溶液中加入4molL﹣1 NaOH溶液,若要使沉淀量达到最大值,则加入的NaOH溶液的体积为多少?
【答案】
(1)解:设镁和铝的物质的量分别为x、y,
根据合金总质量可得:24 g/mol×x+27 g/mol×y=5.1 g
根据电子守恒可得:2x+3y= ![]() ,
,
联立解得:x=0.1 mol,y=0.1 mol,
则该合金中铝和镁的物质的量之比为x:y=1:1,
答:该合金中铝和镁的物质的量之比为1:1
(2)解:加入NaOH溶液,沉淀量达到最大值,此时溶液中的溶质为NaCl,
根据质量守恒定律可得:0.3L×2 molL﹣1=V(NaOH)×4 molL﹣1,
解得:V(NaOH)=0.15L=150 mL,
答:加入的NaOH溶液的体积为150mL
【解析】(1)设出合金中Mg、Al的物质的量,分别根据合金总质量、电子守恒列式计算;(2)当沉淀达到最大时,溶液为氯化钠,根据质量守恒列式计算.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
【题目】利用图示实验装置,能达到实验目标的是
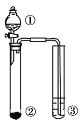
① | ② | ③ | 实验目标 | |
A | 浓盐酸 | MmO2 | 滴有少量K SCN的FeCl2溶液 | 验证FeCl2溶液 |
B | 浓氨水 | 生石灰 | AlC13 溶液 | 验证 Al (OH) 3的 两性 |
C | H2O | 金属钠 | 乙醇溶液 | 验证乙醇能与氢气发生加成反应 |
D | 硫酸 | Na2CO3 | Na2SiO3 溶液 | 验证非金属性S>C>Si |
A. A B. B C. C D. D