题目内容
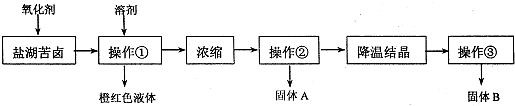
I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如图1流程:
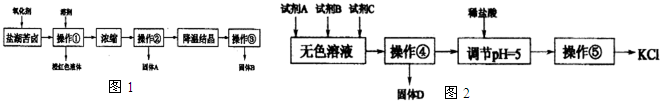
请根据以上流程,回答以下问题:
(1)操作①的名称为 ,溶剂可以选择: .A.四氯化碳B.乙醇C.苯D.己烯
(2)操作②要趁热过滤,所得固体A为 (用化学式表示),操作③所得固体B为 .(用化学式表示)
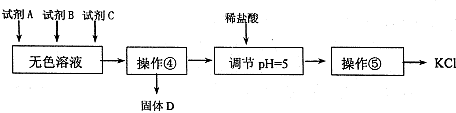
Ⅱ.某同学提出一种新方案,对上述操作①后无色溶液进行除杂提纯,其方案如图2.
(3)无色溶液中先加试剂A(KOH),再加试剂B(BaCl2)最后加试剂C,若C为常见的盐,则试剂C为 (用化学式表示),固体D的主要成分为 (用化学式表示).
(4)用盐酸调节溶液pH=5的过程中,涉及的离子方程式有,:H++OH-═H2O和 .

请根据以上流程,回答以下问题:
(1)操作①的名称为
(2)操作②要趁热过滤,所得固体A为
Ⅱ.某同学提出一种新方案,对上述操作①后无色溶液进行除杂提纯,其方案如图2.
(3)无色溶液中先加试剂A(KOH),再加试剂B(BaCl2)最后加试剂C,若C为常见的盐,则试剂C为
(4)用盐酸调节溶液pH=5的过程中,涉及的离子方程式有,:H++OH-═H2O和
分析:I.图1流程操作为在盐湖苦卤的浓缩液中加入氧化剂应为氯气,可生成溴,通过萃取、分液的方法分离,浓缩后得到硫酸镁和氯化钾的混合液,经重结晶可得硫酸镁,过滤得到氯化钾溶液,经降温结晶,过滤可得到氯化钾;
Ⅱ.对上述操作①后无色溶液含有K+、Mg2+、SO42-、Cl-等离子,无色溶液中先加试剂A(KOH),以除去Mg2+,再加试剂B(BaCl2)以除去SO42-,最后加试剂K2CO3,可除去过量的钡离子,过滤可得到Mg(OH)2、BaSO4沉淀以及少量BaCO3沉淀,然后加入盐酸可除去过量的氢氧化钾和碳酸钾,经蒸发、浓缩、冷却结晶可得到氯化钾.
Ⅱ.对上述操作①后无色溶液含有K+、Mg2+、SO42-、Cl-等离子,无色溶液中先加试剂A(KOH),以除去Mg2+,再加试剂B(BaCl2)以除去SO42-,最后加试剂K2CO3,可除去过量的钡离子,过滤可得到Mg(OH)2、BaSO4沉淀以及少量BaCO3沉淀,然后加入盐酸可除去过量的氢氧化钾和碳酸钾,经蒸发、浓缩、冷却结晶可得到氯化钾.
解答:解:I.(1)图1流程操作为在盐湖苦卤的浓缩液中加入氧化剂应为氯气,可生成溴,通过萃取、分液的方法分离,利用碘易溶于有机溶剂的性质来进行提取,选择能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,符合条件的有四氯化碳、苯,
故答案为:萃取、分液;AC;
(2)硫酸镁在高温下溶解度较小,氯化钾在高温时溶解度大,采用趁热过滤,能除去不溶性杂质硫酸镁,防止氯化钾冷去后析出,然后降温结晶可得氯化钾,
故答案为:MgSO4;KCl;
Ⅱ.(3)操作①后无色溶液含有K+、Mg2+、SO42-、Cl-以及实验的目的是制取较纯净的氯化钾晶体,需先用氢氧化钾除去Mg2+;再用氯化钡除去SO42-,最后再用碳酸钾除去过量的氯化钡,得到的沉淀为氢氧化镁、硫酸钡和碳酸钡,
故答案为:K2CO3;Mg(OH)2、BaSO4、BaCO3;
(3)溶液中含有过量的氢氧根离子、碳酸根离子,所以用盐酸除去过量的氢氧根离子、碳酸根离子,反应的相关离子方程式为H++OH-═H2O、2H++CO32-=H2O+CO2↑,
故答案为:2H++CO32-=H2O+CO2↑.
故答案为:萃取、分液;AC;
(2)硫酸镁在高温下溶解度较小,氯化钾在高温时溶解度大,采用趁热过滤,能除去不溶性杂质硫酸镁,防止氯化钾冷去后析出,然后降温结晶可得氯化钾,
故答案为:MgSO4;KCl;
Ⅱ.(3)操作①后无色溶液含有K+、Mg2+、SO42-、Cl-以及实验的目的是制取较纯净的氯化钾晶体,需先用氢氧化钾除去Mg2+;再用氯化钡除去SO42-,最后再用碳酸钾除去过量的氯化钡,得到的沉淀为氢氧化镁、硫酸钡和碳酸钡,
故答案为:K2CO3;Mg(OH)2、BaSO4、BaCO3;
(3)溶液中含有过量的氢氧根离子、碳酸根离子,所以用盐酸除去过量的氢氧根离子、碳酸根离子,反应的相关离子方程式为H++OH-═H2O、2H++CO32-=H2O+CO2↑,
故答案为:2H++CO32-=H2O+CO2↑.
点评:本题综合考查物质的制备、分离和提纯的实验设计和评价,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意把握物质的分离、提纯原理,根据实验流程解答该题,答题时要注意审题,把握实验的目的和原理.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目