题目内容
我国西部地区有丰富的盐湖资源,对盐湖矿产资源的综合开发利用是西部大开发的重要课题之一.I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO2-4、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
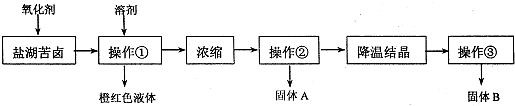
请根据以上流程,回答以下问题:
(1)操作①中的溶剂可以选择:
A.四氯化碳 B.乙醇 C.苯 D.己烯
(2)要从橙红色液体中分离出单质溴,可采取的操作是
(3)操作②要趁热过滤,所起作用是
II 某同学提出一种新方案,对上述操作①后无色溶液进行除杂提纯,其方案如下:
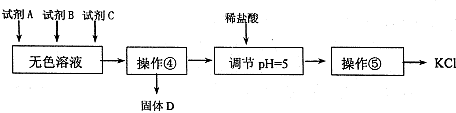
(4)无色溶液中先加试剂A,再加试剂B,最后加试剂C,若C为常见的盐,则试剂C为
(5)若在操作④结束后发现溶液略有浑浊,1应采取的措施是
(6)用盐酸调节溶液pH=5的目的是
(7)进行操作⑤时,除铁架台、蒸发皿外,还要用到的玻璃仪器是
分析:(1)利用碘易溶于有机溶剂的性质来进行提取,须注意:选择的能提取碘的试剂除了对I2有强的溶解能力外,还必须难溶于水,否则不能进行分液分离;
(2)根据相互溶解的液体利用沸点的不同,采用蒸馏的方法的分离;
(3)根据硫酸镁在高温下溶解度较小,氯化钾在高温时溶解度大;
(4)根据操作①后无色溶液含有K+、Mg2+、SO42-、Cl-以及实验的目的是制取较纯净的氯化钾晶体,需先用氢氧化钾除去Mg2+;再用氯化钡除去SO42-,最后再用碳酸钾除去过量的氯化钡;
(5)根据溶液略有浑浊,说明滤纸破损;
(3)根据溶液中含有过量的氢氧根离子、碳酸根离子;
(7)根据蒸发结晶需要铁架台、蒸发皿、玻璃棒、酒精灯.
(2)根据相互溶解的液体利用沸点的不同,采用蒸馏的方法的分离;
(3)根据硫酸镁在高温下溶解度较小,氯化钾在高温时溶解度大;
(4)根据操作①后无色溶液含有K+、Mg2+、SO42-、Cl-以及实验的目的是制取较纯净的氯化钾晶体,需先用氢氧化钾除去Mg2+;再用氯化钡除去SO42-,最后再用碳酸钾除去过量的氯化钡;
(5)根据溶液略有浑浊,说明滤纸破损;
(3)根据溶液中含有过量的氢氧根离子、碳酸根离子;
(7)根据蒸发结晶需要铁架台、蒸发皿、玻璃棒、酒精灯.
解答:解:(1)利用碘易溶于有机溶剂的性质来进行提取,选择能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,符合条件的有四氯化碳、苯,故答案为:AC;
(2)溴与有机溶剂互溶,但沸点的不同,采用蒸馏的方法的分离,故答案为:蒸馏;
(3)硫酸镁在高温下溶解度较小,氯化钾在高温时溶解度大,采用趁热过滤,能除去不溶性杂质硫酸镁,防止氯化钾冷去后析出,
故答案为:除去不溶性杂质硫酸镁,防止氯化钾冷去后析出;
(4)操作①后无色溶液含有K+、Mg2+、SO42-、Cl-以及实验的目的是制取较纯净的氯化钾晶体,需先用氢氧化钾除去Mg2+;再用氯化钡除去SO42-,最后再用碳酸钾除去过量的氯化钡,得到的沉淀为氢氧化镁、硫酸钡和碳酸钡,
故答案为:碳酸钾;氢氧化镁、硫酸钡、碳酸钡;
(5)溶液略有浑浊,说明滤纸破损,所以应更换滤纸,重新过滤,故答案为:更换滤纸,重新过滤;
(6)溶液中含有过量的氢氧根离子、碳酸根离子,所以用盐酸除去过量的氢氧根离子、碳酸根离子,
故答案为:除去过量的氢氧根离子、碳酸根离子,
(7)操作⑤为蒸发结晶,蒸发结晶需要铁架台、蒸发皿、玻璃棒、酒精灯,所以除铁架台、蒸发皿外,还要用到的玻璃仪器是玻璃棒、酒精灯,故答案为:玻璃棒、酒精灯.
(2)溴与有机溶剂互溶,但沸点的不同,采用蒸馏的方法的分离,故答案为:蒸馏;
(3)硫酸镁在高温下溶解度较小,氯化钾在高温时溶解度大,采用趁热过滤,能除去不溶性杂质硫酸镁,防止氯化钾冷去后析出,
故答案为:除去不溶性杂质硫酸镁,防止氯化钾冷去后析出;
(4)操作①后无色溶液含有K+、Mg2+、SO42-、Cl-以及实验的目的是制取较纯净的氯化钾晶体,需先用氢氧化钾除去Mg2+;再用氯化钡除去SO42-,最后再用碳酸钾除去过量的氯化钡,得到的沉淀为氢氧化镁、硫酸钡和碳酸钡,
故答案为:碳酸钾;氢氧化镁、硫酸钡、碳酸钡;
(5)溶液略有浑浊,说明滤纸破损,所以应更换滤纸,重新过滤,故答案为:更换滤纸,重新过滤;
(6)溶液中含有过量的氢氧根离子、碳酸根离子,所以用盐酸除去过量的氢氧根离子、碳酸根离子,
故答案为:除去过量的氢氧根离子、碳酸根离子,
(7)操作⑤为蒸发结晶,蒸发结晶需要铁架台、蒸发皿、玻璃棒、酒精灯,所以除铁架台、蒸发皿外,还要用到的玻璃仪器是玻璃棒、酒精灯,故答案为:玻璃棒、酒精灯.
点评:本题主要考查了物质的制备,同时考查了物质的除杂和分离、常见的化学实验操作,题目新颖、灵活.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
| |||||||||||||||||||||||||||||||||