��Ŀ����
����Ŀ����1����֪2H��H2�ų�437.6 kJ������������˵����ȷ����_______
A. ����������ÿ����ԭ�Ӷ��ﵽ�ȶ��ṹ
B. �������ӵ�������������ԭ�ӵ�������
C. 1 mol H2 ���� 2 mol H Ҫ�ų�437.6 kJ����
D. ��ԭ�ӱ����������ȶ�
��2����֪ԭ��ص��ܷ�Ӧʽ��Cu + 2FeCl3 = CuCl2 + 2FeCl2����д���缫��Ӧ����ʽ��
����___________________________________
����___________________________________
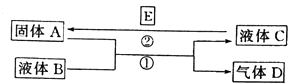
��3����ͼ��ʾ������ƿ����װ��ˮ��С�Թܣ���С�Թ��зֱ�����������ʣ����ռ���� ��Ũ���� ������粒����NaCl���壬������ʹa��Һ�����b��Һ�����_______________��������ţ�

��4����ѧ��������Ƴ�����̫���ܲ������⣬���ڶ������ѣ�TiO2����������ʹ��ˮ�ֽ�õ��������¼���2H2O![]() 2H2��+O2�����Ƶõ���������������ȼ�ϵ�أ��Իش��������⣺
2H2��+O2�����Ƶõ���������������ȼ�ϵ�أ��Իش��������⣺
�ٷֽ⺣ˮʱ��ʵ���˹���ת��Ϊ______�ܣ����ɵ�������������ȼ�ϵ��ʱ��ʵ���˻�ѧ��ת��Ϊ______�ܣ��ֽ⺣ˮ�ķ�Ӧ����______��Ӧ��������������������������
��ij������ȼ�ϵ�����ù�������������մ�������ʣ�A���Ϸ����ĵ缫��ӦΪ��2H2 + 2O24e=2H2O����A���ǵ�ص�______�������ӴӸü�______��������������������������B���ĵ缫��ӦʽΪ��_____________________��
���𰸡� A��B Cu �C 2e = Cu2+ 2Fe3+ + 2e = 2Fe2+ �� ��ѧ �� ���� ���� ���� O2 +4e =2O2
����������1����֪2H��H2�ų�437.6 kJ��������A. ������������һ�Թ��õ��Ӷԣ�ÿ����ԭ�Ӷ��ﵽHe���ȶ��ṹ��A��ȷ�� B. ����ԭ�ӱ�Ϊ���������ͷ����� �������������ӵ�������������ԭ�ӵ���������B��ȷ�� C. 1 mol H2 ���� 2 mol H Ҫ����437.6 kJ������C����ȷ�� D. ����Խ��Խ�ȶ������������ӱ���ԭ���ȶ���D����ȷ������������˵����ȷ����AB��
��2����ԭ��ص��ܷ�ӦʽCu + 2FeCl3 = CuCl2 + 2FeCl2����֪Cu����������������Ӧ��Fe3+�������Ϸ�����ԭ��Ӧ�������缫��ӦʽΪCu �C 2e = Cu2+�������缫��ӦʽΪ2Fe3+ + 2e = 2Fe2+ ��
��3����ͼ��֪������С�Թ��м����ռ��Ũ���ᣬ��������ˮ���ȣ���ƿ��������������ѹ�����ʹa��Һ�����b��Һ��������С�Թ��м������������������ˮ���ȣ���ƿ����ѹ��С����ʹa��Һ�����b��Һ�档������������ʹa��Һ�����b��Һ����Ǣ���
��4��������̫���ܲ�������ֽ⺣ˮʱ��ʵ���˹���ת��Ϊ��ѧ�ܣ����ɵ�������������ȼ�ϵ��ʱ����ѧ����ת��Ϊ���ܣ��ֽ⺣ˮ�ķ�Ӧ�������ȷ�Ӧ��
��ij������ȼ�ϵ�����ù�������������մ�������ʣ�A���Ϸ����ĵ缫��ӦΪ2H2 + 2O24e=2H2O���÷�ӦΪ������Ӧ����A���ǵ�صĸ��������ӴӸü�������B��Ϊ������������ԭ��Ӧ���缫��ӦʽΪO2 +4e =2O2��

����Ŀ������ʵ���о��к���ɫ����������Աȷ������ý��۲���ȷ���ǣ�������
|
|
|
�� | �� | �� |
A. �����еĺ���ɫ���壬�ƶϲ���������һ���ǻ������
B. ����ɫ���岻�ܱ�������ľ̿��Ũ��������˷�Ӧ
C. ����˵��Ũ������лӷ��ԣ����ɵĺ���ɫ����Ϊ��ԭ����
D. ������������м���CO2���ɴ�˵��ľ̿һ����Ũ���ᷢ���˷�Ӧ