题目内容
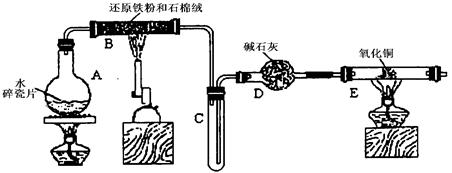
(12分)下图为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中:A处为无水乙醇(沸点为78℃);B处为绕成螺旋状的细铜丝或银丝;C处为无水CuSO4粉末;D处为碱石灰;F处为新制的碱性Cu(OH)2悬浊液。
(1)在上述装置中,实验时需要加热的仪器按加热的先后顺序排列为(填序号)_________________,E处是一种纯净物,其发生反应的化学方程式为 。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是 ,D处使用碱石灰的作用是 。
(3) 能证明乙醇反应后所生成的产物的实验现象是 。
(4)本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同,B处发生反应的化学方程式是 。
(1)B、E、A、F;2KMnO4K2MnO4+MnO2+O2↑
(2)将试管放入78℃(或略高于78℃)的热水浴中;防止F中水蒸气与无水CuSO4反应。
(3)C处无水硫酸铜变蓝,F处产生红色沉淀。(4)
解析:

A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为 ?? ,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于 ?? ,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是 ?? 。
(2)当n=2时,B原子的结构示意图为 ?? ,B与C形成的晶体属于 晶体。当n=3时,B与C形成的晶体中,B原子的杂化方式为 ?? ,该晶体中最小的环共有 ?? 个微粒构成,微粒间的作用力是 ?? 。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是 ?? ,A、B、C、D四种元素的第一电离能由大到小的顺序是
?? (用元素符号表示)。
B.(实验化学,12分)某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。
 (1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
| 编号 | I | II | III | IV | V |
| V(O2)/mL | 60 | 40 | 20 | 12 | 10 |
| V(空气)/mL | 40 | 60 | 80 | 88 | 90 |
| 现象 | 木炭复燃 | 木炭复燃 | 木炭复燃 | 木炭有时燃烧,有时不燃烧 | 木炭 不复燃 |
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为 ?? 。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?答: ?? (填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?
答: ?? (“能”、“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
| 编号 | 制取气体A(下列反应产生的混合气体) | B中的现象 | 结论 |
| a | 在烧瓶中加热适量浓HNO3 4HNO3 △ 4NO2↑+O2↑+2H2O↑ | 充满红棕色气体,木炭不复燃,火星熄灭 | NO2不支持燃烧 |
| b | 加热AgNO3固体 2AgNO3 △ 2NO2↑+O2↑+2Ag | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
| c | 加热Cu(NO3)2固体 2Cu(NO3)2 △ 4NO2↑+O2↑+2CuO | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a. ?? ,原因是 ?? 。
b. ?? ,原因是 ?? 。
c. ?? ,原因是 ?? 。
 Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号) H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑



 (1)写出常温下单质X2与Z反应的离子方程式
(1)写出常温下单质X2与Z反应的离子方程式

