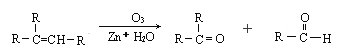题目内容
【题目】已知化合物X仅由三种短周期元素组成,X隔绝空气加热,可分解为盐A和气体B,有关该反应的物质转换、现象和量的关系如下图所示。

(1)检验盐A中阳离子的方法及现象是____________。
(2)请用双桥法分析并表达化合物X分解时,电子转移的方向和数目____________。
(3)白色沉淀C在紫外光照射下会发生分解,请写出该反应的化学方程式____________。
【答案】焰色反应,有黄色火焰  2AgCl=2Ag+Cl2↑
2AgCl=2Ag+Cl2↑
【解析】
气体B的物质的量是![]() ;根据质量守恒,B的质量是25.56g-14.04g=11.52g,气体B的相对分子质量是
;根据质量守恒,B的质量是25.56g-14.04g=11.52g,气体B的相对分子质量是![]() 32,所以B是氧气,氧原子的物质的量是0.72mol;A和硝酸银反应生成的白色沉淀C是AgCl,AgCl的物质的量是
32,所以B是氧气,氧原子的物质的量是0.72mol;A和硝酸银反应生成的白色沉淀C是AgCl,AgCl的物质的量是![]() ,即X中含有氯元素0.24mol,可知n(O): n(Cl)=3:1,所以X中含有
,即X中含有氯元素0.24mol,可知n(O): n(Cl)=3:1,所以X中含有![]() ,X中金属元素的质量为14.04g-0.24mol×35.5g/mol=5.52g;若金属元素为+1价,则金属元素的物质的量是0.24mol,相对原子质量是
,X中金属元素的质量为14.04g-0.24mol×35.5g/mol=5.52g;若金属元素为+1价,则金属元素的物质的量是0.24mol,相对原子质量是![]() ;若金属元素为+2价,则金属元素的物质的量是0.12mol,相对原子质量是
;若金属元素为+2价,则金属元素的物质的量是0.12mol,相对原子质量是![]() ,不可能是短周期元素,与题意不符;所以X是NaClO3;
,不可能是短周期元素,与题意不符;所以X是NaClO3;
(1)X是NaClO3,分解为NaCl和O2,A是NaCl,钠元素的焰色为黄色,用焰色反应检验钠离子。
(2)NaClO3分解为NaCl和O2,氯元素化合价由+5降低为-1,氧元素化合价由-2升高为0,NaClO3分解时,电子转移的方向和数目为 ;
;
(3)白色沉淀C是AgCl,在紫外光照射下会发生分解生成银和氯气,反应的化学方程式是2AgCl=2Ag+Cl2↑。

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目