题目内容
(15分)血红素中含有C、O、N、Fe五种元素。回答下列问题:
⑴C、N、O、H四种元素中电负性最小的是 (填元素符合),写出基态Fe原子的核外电子排布式 。
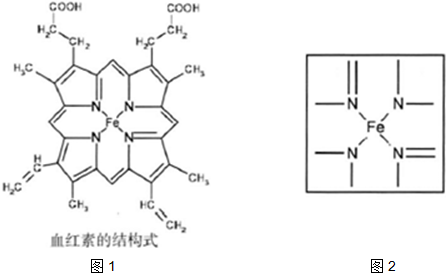
⑵下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有 ,在右图的方框内用“→”标出Fe2+的配位键。
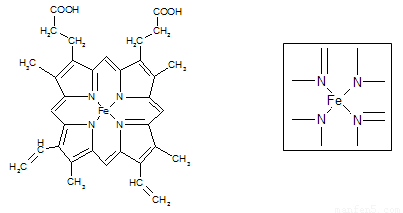
⑶NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
⑷N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:

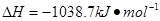
若该反应中有4mol
N—H键断裂,则形成的 键有___________mol。
键有___________mol。
⑸根据等电子原理,写出CN—的电子式 , 1 mol O22+中含有的π键数目为 。
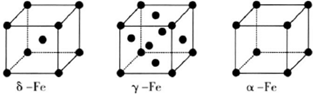
⑹铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。

⑴H (1分) [Ar]3d64S2(2分)
⑵sp2 sp3 (2分)
如图 (2分) ⑶>(1分) ⑷ 3(1分)
(2分) ⑶>(1分) ⑷ 3(1分)
⑸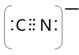 (2分) 2NA(2分)
⑹4 (1分) 4∶3(1分)
(2分) 2NA(2分)
⑹4 (1分) 4∶3(1分)
【解析】(1)非金属性越强,电负性越大,故是H。根据构造原理可写出基态Fe原子的核外电子排布式。
(2)根据结构图可看出N原子既有单键还有双键,所以既有sp2杂化,还有sp3杂化。N原子最外层有孤对电子,而亚铁离子有容纳电子的空轨道,所以可形成配位键。
(3)离子晶体中离子键越强,熔沸点越高,形成离子键的微粒半径越小,所带电荷数越多,离子键越强,所以NiO> FeO的。
(4)反应中有4mol
N—H键断裂,则生成1.5mol氮气,氮氮三键由2个 键构成,即形成的
键构成,即形成的 键有3mol。
键有3mol。
(5)CN—与氮气是等电子体,其电子式为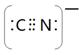 。O22+与氮气也是等电子体,所以含有2个
。O22+与氮气也是等电子体,所以含有2个 键。
键。
(6)8个顶点各有1个铁原子,6个面心处各有1个铁原子,所以含有的铁原子是8×1/8+6×1/2=4。δ、α两种晶胞中铁原子的配位数分别为8和6,所以之比是4∶3。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案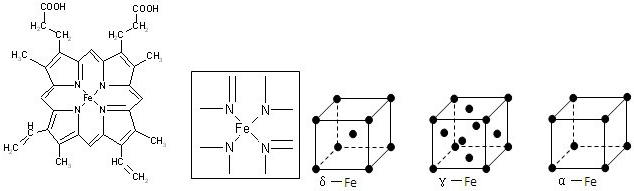
 键有___________mol。
键有___________mol。
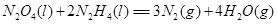
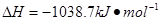
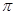 键有___________mol。
键有___________mol。