��Ŀ����
��Ҫ����д�������⣺
��1��ijЩ���ۻ������H2O��NH3��N2O4�ȣ���Һ̬ʱ�ᷢ�����ĵ��룬�磺2H2O  H3O+ + OH��,��Һ̬NH3����ķ���ʽ��_______________________
H3O+ + OH��,��Һ̬NH3����ķ���ʽ��_______________________
��2��ij�¶ȣ�t�棩ʱ�����0.01mol/L��NaOH��Һ��pH=11������¶���ˮ��KW=_______���ڴ��¶��£���pH=a��H2SO4��ҺVa L��pH=b��NaOH��ҺVb L��ϣ������û��ҺΪ���ԣ���a+b=12����Va:Vb=_________
��3��һ�������£�CO�����ĩ״�����������������ɼ����ơ�
�ٳ���ʱ������ĵ���ƽ�ⳣ��Ka=1.70��10-4�������Ƶ�ˮ��Һ�ʼ��ԣ��������ӷ�Ӧ����ʽ��ʾ��ԭ�� ____________��0.1mol/L�ļ�������ҺpHԼΪ_______����֪��lg17 ��1.23, ����������һλС����
����20ml 0.1mol/L�ļ�������Һ��С�ĵμ�10ml 0.1mol/L�����ᣬ���Һ�����ԣ��밴�ɴ�С��˳�����Һ������Ũ������_______________
��4������ʱ��M(OH)2(s) M2+(aq) + 2OH��(aq)��Ksp��a��c(M2+)��b mol��L?1ʱ����Һ��pH����_________
M2+(aq) + 2OH��(aq)��Ksp��a��c(M2+)��b mol��L?1ʱ����Һ��pH����_________
 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д���һ������SO2(g)��O2(g)�ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ��2 SO2(g)+ O2(g) 2SO3��g�� ��H<0���õ�����е��������ݣ�
2SO3��g�� ��H<0���õ�����е��������ݣ�
ʵ���� | �¶�/�� | ƽ�ⳣ��/mol-1��L | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |||
SO2 | O2 | SO2 | O2 | |||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 | |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t | |
����˵������ȷ���ǣ� ��
A. ʵ��1��ǰ6min��ƽ����Ӧ���ʦ�(SO2)=0.2 mol��L-1��min-1
B. T1��T2�Ĺ�ϵ��T1 �� T2
C. K1��K2�Ĺ�ϵ��K2��K1
D. x= 1.6��y=0.2 ��t<6


 Li1-xMO2+LixCn (M������Co��Ni��Fe��)���ڲ��ṹ��ͼ��ʾ�������й�˵����ȷ����
Li1-xMO2+LixCn (M������Co��Ni��Fe��)���ڲ��ṹ��ͼ��ʾ�������й�˵����ȷ����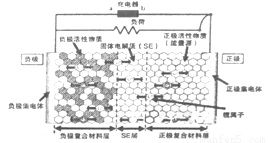
 ������Ҫ�Ļ�������ԭ�ϣ�Ӧ��ʮ�ֹ㷺����ҵ�Ʊ��췯�Ƶ��������£�
������Ҫ�Ļ�������ԭ�ϣ�Ӧ��ʮ�ֹ㷺����ҵ�Ʊ��췯�Ƶ��������£�
 �Ļ�̬�����Ų�ʽΪ____________��
�Ļ�̬�����Ų�ʽΪ____________�� ��ƽ������ѧ��Ӧ����ʽ��
��ƽ������ѧ��Ӧ����ʽ�� ����Ȼ��ת��ΪCr(OH)3�� Fe(0H)3 ������
����Ȼ��ת��ΪCr(OH)3�� Fe(0H)3 ������ �����Է�ˮ��CrԪ�صĺ�����52.5mg/L,������CrԪ��������� ����Ϊ0.5 mg/L��Ҫ����100 m3��ˮ�ﵽ�ŷű�������������_____kg��
�����Է�ˮ��CrԪ�صĺ�����52.5mg/L,������CrԪ��������� ����Ϊ0.5 mg/L��Ҫ����100 m3��ˮ�ﵽ�ŷű�������������_____kg��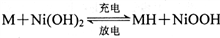 ������˵����ȷ����
������˵����ȷ����