题目内容
A、B、C、为三种常见的单质,其中A、C为气体,B为常见金属.A溶于水可使石蕊试液先变红后褪色.F的水溶液为浅绿色溶液,它们的关系如图1:
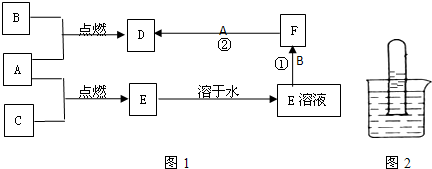
(1)写出A、B、D的化学式:A.
(2)写出反应①②的离子方程式:①
(3)A溶于水使石蕊试液先变红后褪色的原因是:
(4)检验D的水溶液中的阳离子的方法是(指出药品、试剂、步骤和现象):
(5)某同学将A的饱和溶液装满大试管倒置在烧杯中如图2,光照一段时间后,发现试管底部有无色的气体产生,溶液的颜色也变成无色,请你帮他对产生的气体进行探究:
①你预测气体可能是
②针对你的预测写出验证实验方案(步骤和现象):

(1)写出A、B、D的化学式:A.
Cl2
Cl2
B.Fe
Fe
C.FeCl3
FeCl3
(2)写出反应①②的离子方程式:①
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
;②2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.(3)A溶于水使石蕊试液先变红后褪色的原因是:
因Cl2+H2O=HCl+HClO,HCl使石蕊试液变红,HClO具有漂白性
因Cl2+H2O=HCl+HClO,HCl使石蕊试液变红,HClO具有漂白性
.(4)检验D的水溶液中的阳离子的方法是(指出药品、试剂、步骤和现象):
取少量溶液于试管中,滴加两次KSCN溶液,溶液变红
取少量溶液于试管中,滴加两次KSCN溶液,溶液变红
.将D溶液逐滴加入的沸水中会产生一种红褐色的液体.你认为该液体中的分散质粒子直径在1nm-100nm
1nm-100nm
之间,验证的简单方法是:是否有丁达尔效应
是否有丁达尔效应
.(5)某同学将A的饱和溶液装满大试管倒置在烧杯中如图2,光照一段时间后,发现试管底部有无色的气体产生,溶液的颜色也变成无色,请你帮他对产生的气体进行探究:
①你预测气体可能是
O2或H2
O2或H2
②针对你的预测写出验证实验方案(步骤和现象):
在水下堵住试管口,取出正放,用燃着的木条放在试管口,如果气体燃烧说明是H2,如果木条燃烧更狂说明是O2
在水下堵住试管口,取出正放,用燃着的木条放在试管口,如果气体燃烧说明是H2,如果木条燃烧更狂说明是O2
.分析:A溶于水所得的溶液可使石蕊试液先变红后退色,则说明A为Cl2,与水反应生成HCl和HClO,能使石蕊试液先变红后褪色,
F的水溶液为浅绿色溶液,说明F中含有Fe2+,能继续和Cl2反应生成D,则D为FeCl3,所以B为Fe,则C为H2,E为HCl,以此解答(1)(2)(3)题;
(4)检验Fe3+,可用KSCN溶液,观察溶液是否变红;
(4)Cl2 与水反应生成HCl和HClO,HClO不稳定,易分解生成氧气.
F的水溶液为浅绿色溶液,说明F中含有Fe2+,能继续和Cl2反应生成D,则D为FeCl3,所以B为Fe,则C为H2,E为HCl,以此解答(1)(2)(3)题;
(4)检验Fe3+,可用KSCN溶液,观察溶液是否变红;
(4)Cl2 与水反应生成HCl和HClO,HClO不稳定,易分解生成氧气.
解答:解:(1)A溶于水所得的溶液可使石蕊试液先变红后退色,则说明A为Cl2,与水反应生成HCl和HClO,能使石蕊试液先变红后褪色,F的水溶液为浅绿色溶液,说明B中含有Fe2+,能继续和Cl2反应生成D,则D为FeCl3,所以B为Fe,则C为H2,E为HCl,故答案为:Cl2;Fe;FeCl3;
(2)反应①为Fe和盐酸的反应,反应的离子方程式为Fe+2H+═Fe2++H2↑,FeCl2具有还原性,能与具有氧化性的Cl2反应生成FeCl3,反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,
故答案为:Fe+2H+=Fe2++H2↑;2Fe2++Cl2=2Fe3++2Cl-;
(3)Cl2和水反应生成HCl和HClO,涉及反应为Cl2+H2O=HCl+HClO,HCl具有酸性,HClO具有氧化性和漂白性,可使石蕊试液褪色,
故答案为:因Cl2+H2O=HCl+HClO,HCl使石蕊试液变红,HClO具有漂白性;
(4)检验Fe3+,可用KSCN溶液,观察溶液是否变红,具体做法为取少量溶液于试管中,滴加两滴KSCN溶液,观察溶液是否变红色,将饱和FeCl3溶液滴加到沸水中生成氢氧化铁胶体,分散质粒子直径应该在1nm~100nm之间,具有丁达尔效应,
故答案为:取少量溶液于试管中,滴加两次KSCN溶液,溶液变红; 1nm-100nm; 是否有丁达尔效应;
(5)①无色气体可能为氧气或氢气,但Cl2与水反应生成HCl和HClO,根据HClO的不稳定性,易分解生成氧气,故答案为:O2或H2;
②根据氢气和氧气的性质碱性检验,氢气易燃烧,氧气能使木条复燃,具体做法是在水下堵住试管口,取出正放,用燃着的木条放在试管口,如果气体燃烧说明是H2;如果木条燃烧更旺说明是O2,
故答案为:在水下堵住试管口,取出正放,用燃着的木条放在试管口,如果气体燃烧说明是H2,如果木条燃烧更狂说明是O2.
(2)反应①为Fe和盐酸的反应,反应的离子方程式为Fe+2H+═Fe2++H2↑,FeCl2具有还原性,能与具有氧化性的Cl2反应生成FeCl3,反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,
故答案为:Fe+2H+=Fe2++H2↑;2Fe2++Cl2=2Fe3++2Cl-;
(3)Cl2和水反应生成HCl和HClO,涉及反应为Cl2+H2O=HCl+HClO,HCl具有酸性,HClO具有氧化性和漂白性,可使石蕊试液褪色,
故答案为:因Cl2+H2O=HCl+HClO,HCl使石蕊试液变红,HClO具有漂白性;
(4)检验Fe3+,可用KSCN溶液,观察溶液是否变红,具体做法为取少量溶液于试管中,滴加两滴KSCN溶液,观察溶液是否变红色,将饱和FeCl3溶液滴加到沸水中生成氢氧化铁胶体,分散质粒子直径应该在1nm~100nm之间,具有丁达尔效应,
故答案为:取少量溶液于试管中,滴加两次KSCN溶液,溶液变红; 1nm-100nm; 是否有丁达尔效应;
(5)①无色气体可能为氧气或氢气,但Cl2与水反应生成HCl和HClO,根据HClO的不稳定性,易分解生成氧气,故答案为:O2或H2;
②根据氢气和氧气的性质碱性检验,氢气易燃烧,氧气能使木条复燃,具体做法是在水下堵住试管口,取出正放,用燃着的木条放在试管口,如果气体燃烧说明是H2;如果木条燃烧更旺说明是O2,
故答案为:在水下堵住试管口,取出正放,用燃着的木条放在试管口,如果气体燃烧说明是H2,如果木条燃烧更狂说明是O2.
点评:本题考查无机物的推断,题目难度不大,本题注意两点:①A溶于水所得的溶液可使石蕊试液先变红后退色,则说明A为Cl2,②F的水溶液为浅绿色溶液,说明F中含有Fe2+.

练习册系列答案
相关题目
(12分)有A、B、C 、D、E、F、G 六种前四周期元素,原子序数依次增大,其相关信息如下表:
|
元素编号 |
相关信息 |
|
A |
所处的周期数、族序数分别与其原子序数相等 |
|
B |
基态时,电子分布在三个能级上,且各能级中电子数相等 |
|
C |
基态时, 2p 轨道处于半充满状态 |
|
D |
与C元素处于同一周期,且D的第一电离能小于C的第一电离能 |
|
E |
原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
F |
与E同周期,原子核外所有p轨道:有的全满有的半满 |
|
G |
是第四周期元素中未成对电子数最多的元素 |
请回答下列问题:
(1)A、B两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为 ,其中B原子采取 杂化。
(2)B、C、D三种元素的电负性由大到小的顺序为 (用元素符号表示)。
(3)C的氢化物比F的氢化物的沸点__________(填“高”或“低”),C的氢化物比F的氢化物的稳定性__________(填“强”或“弱”)。
(4)A2D的VSEPR模型名称为__________;
写出与A2D分子互为等电子体的微粒__________(填一种)
(5)写出E3C2的电子式 ;
(6)G的基态原子核外电子排布式为 。
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.