题目内容
10.常温下,已知0.1mol•L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8.①常温下,0.1mol•L-1 HA溶液的pH=3;写出该酸(HA)与NaOH溶液反应的离子方程式:HA+OH-=A-+H2O;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:c(A-)>c(Na+)>c(H+)>c(OH-);
③0.2mol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合后所得溶液中:
c(H+)+c(HA)-c(OH-)=0.05mol•L-1.(溶液体积变化忽略不计)
分析 ①0.1mol•L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8,则c(OH-)=10-11mol/L,c(H+)=1.0×10-3mol/L,依据pH=-lgc(H+)计算该溶液的pH;根据计算判断HA为弱电解质,然后写出其与氢氧化钠溶液的反应的离子方程式;
②根据酸和碱的物质的量的相对大小确定溶液中的溶质,从而确定溶液的酸碱性,结合电离平衡、水解平衡、电荷守恒等确定溶液中各种离子浓度的相对大小;
③根据电荷守恒与物料守恒进行计算.
解答 解:①0.1mol•L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8,根据水的离子积可得:c(OH-)=10-11mol/L、c(H+)=1.0×10-3mol/L,该溶液的pH=-lgc(H+)=3;说明HA在溶液中只能部分电离出氢离子,则HA为弱酸,该酸(HA)与NaOH溶液反应的离子方程式为:HA+OH-=A-+H2O,
故答案为:3;HA+OH-=A-+H2O;
②常温下pH=11的NaOH溶液中c(OH-)=10-3mol•L-1,HA是弱酸,酸的浓度远远大于氢离子浓度,溶液中的溶质是酸和盐,溶液呈酸性,所以溶液中氢离子浓度大于氢氧根离子浓度,酸根离子浓度大于钠离子浓度,溶液中4种离子物质的量浓度大小关系为:c(A-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(A-)>c(Na+)>c(H+)>c(OH-);
②0.2mol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合后所得溶液中,由电荷守恒可得:c(Na+)+c(H+)=c(A-)+c(OH-),由物料守恒可得:2c(Na+)=c(A-)+c(HA),二者结合可得:c(H+)+c(HA)-c(OH-)=c(Na+)=$\frac{1}{2}$×0.1mol/L=0.05mol/L,
故答案为:0.05.
点评 本题考查了酸碱混合后溶液定性判断及溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒、盐的水解原理正确判断溶液中各离子浓度大小.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案①蒸馏 ②过滤 ③分液 ④加入足量的钠⑤通入过量的C02⑥加入足量的NaOH溶液⑦加人足 FeCl3溶液⑧加入乙醇和浓硫酸的混合液⑨加人足 量的浓溴水⑩加人适量的盐酸.
| A. | ④⑤⑩ | B. | ⑥①⑤③ | C. | ⑨②⑧① | D. | ⑦①③⑩ |
| A. | Zn为正极 | B. | 负极反应式:O2+4H++4e-→2H2O | ||
| C. | 正极发生氧化反应 | D. | 电解液肯定不是强酸 |
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
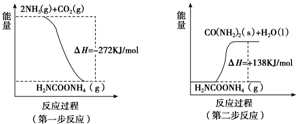
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式:
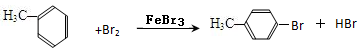 或
或
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
| A. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| B. | 1 mol•L-1的烧碱溶液中:S2-、SO32-、SO42-、K+ | |
| C. | 使淀粉碘化钾试纸变蓝的溶液:Cs+、Ba2+、S2-、Cl- | |
| D. | 含有大量HCO3-的澄清透明溶液中:K+、NH4+、SO42-、MnO4- |
| 方案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和(CuSO4) |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 制化肥 | B. | 制漂白粉 | ||
| C. | 酸洗 | D. | 医药、制炸药、农药 |
| A. | 铜有优良的导电性 | B. | 铜在干燥的空气中不易被氧化变质 | ||
| C. | 铜较易冶炼,属常见金属 | D. | 铜的密度比较大 |