题目内容
(5分)硫代硫酸钠溶液与稀硫酸的反应方程式为:
Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,
某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。
(1)实验目的:装置甲,探究浓度对化学反应速率的影响;装置乙,探究 对化学反应速率的影响。
(2)通过甲、乙装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
| 实验 组号 | 温度] | Na2S2O3溶液 | H2SO4 | 加入H2O的体积 | 出现沉淀所需时间 | ||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| Ⅰ | 0℃ | 5mL | 0.1mol·L-1 | 10mL | 0.1mol·L-1 | 5mL | 8s |
| Ⅱ | 0℃ | 5mL | 0.1mol·L-1 | 5mL | 0.1mol·L-1 | 10mL | 12s |
| Ⅲ | 30℃ | 5mL | 0.1mol·L-1 | 5mL | 0.1mol·L-1 | 10mL | 4s |
结论2:由Ⅱ和Ⅲ两组数据可知 。
(5分)(1)温度(1分)
(2)其它条件一定时,反应物浓度越大,化学反应速率越快(2分)
其它条件一定时,温度越高,化学反应速率越快(2分)
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(2009?辽宁)硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
| ||||||||||||||||||||||||||||||||||||||||
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol·L—1 | V/mL | c/mol·L—1 | V/mL | ||
| A | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4===Na2SO4+SO2+S↓+H2O,
下列各组实验中最先出现浑浊的是( )
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
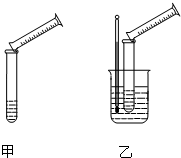 硫代硫酸钠溶液与稀硫酸的反应方程式为:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某实验兴趣小组用如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略).
硫代硫酸钠溶液与稀硫酸的反应方程式为:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某实验兴趣小组用如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略).