题目内容
下列说法正确的是
| A.某一反应的活化分子百分数是个定值 |
| B.升高温度会加快化学反应速率,其原因是增加了活化分子百分数 |
| C.活化分子之间发生的碰撞一定为有效碰撞 |
| D.对有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子百分数,从而使反应速率增大 |
B
A 错误,某一反应的活化分子百分数不是定值,随温度、压强的改变而改变。
B 正确,升温,活化分子百分数增多,有效碰撞增多,反应速率加快。
C 错误,活化分子之间发生的碰撞不一定为有效碰撞
D 错误,对有气体参加的化学反应,加压,可增加活化分子数,活化分子百分数不变。
B 正确,升温,活化分子百分数增多,有效碰撞增多,反应速率加快。
C 错误,活化分子之间发生的碰撞不一定为有效碰撞
D 错误,对有气体参加的化学反应,加压,可增加活化分子数,活化分子百分数不变。

练习册系列答案
相关题目
 4C(g)+6D(g)在0.50 L密闭容器中进行,半分 钟后,A减少了0.90 mol,则此反应的平均速率可以表示为 ( )
4C(g)+6D(g)在0.50 L密闭容器中进行,半分 钟后,A减少了0.90 mol,则此反应的平均速率可以表示为 ( )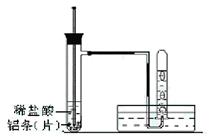

 2SO3,如果SO2的起始浓度为2 mol/L ,2min后SO2的浓度为1.8mol/L,则用SO2的浓度变化表示的反应速率为:
2SO3,如果SO2的起始浓度为2 mol/L ,2min后SO2的浓度为1.8mol/L,则用SO2的浓度变化表示的反应速率为: 2SO3 (g) ,△H < 0 。如图4是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的原因可能是( )
2SO3 (g) ,△H < 0 。如图4是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的原因可能是( )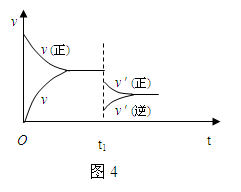
 2NH3,下列表示其反应最快的是
2NH3,下列表示其反应最快的是 2C(g)的反应,如果A的平均反应速率为0·12mol/(L·s),则10 s时容器中的B是
2C(g)的反应,如果A的平均反应速率为0·12mol/(L·s),则10 s时容器中的B是 Ag2O(s)+SO3(g),② 2SO3(g)
Ag2O(s)+SO3(g),② 2SO3(g)