题目内容
【题目】下列两组热化学方程式中,有关△H的比较正确的是( ) ①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H2
②NaOH(aq)+ ![]() H2SO4(浓)═
H2SO4(浓)═ ![]() Na2SO4(aq)+H2O(l)△H3
Na2SO4(aq)+H2O(l)△H3
NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H4 .
A.△H1>△H2;△H3>△H4
B.△H1>△H2;△H3<△H4
C.△H1=△H2;△H3<△H4
D.△H1<△H2;△H3<△H4
【答案】B
【解析】解:①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H2 , 两个反应都是放热反应,后者生成液态水,所以后者放出的热量大于前者,而放热反应△H小于0,放热越多,焓变值越小,故△H1>△H2;②NaOH(aq)+ ![]() H2SO4(浓)═
H2SO4(浓)═ ![]() Na2SO4(aq)+H2O(l);△H3、NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l);△H4 . 两个反应的实质是酸碱中和,都是放热反应,两个反应生成水的物质的量都是1mol,但是CH3COOH(aq)是弱电解质,电离过程吸收一部分热量,所以后者放出的热量小,所以△H3<△H4 , 故选B. △H为化学反应的焓变,放热反应的△H<0,吸热反应的△H>0;反应的热效应与反应物和生成物的状态有关,反应放出热量越大,焓变数值越小,据此进行解答.
Na2SO4(aq)+H2O(l);△H3、NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l);△H4 . 两个反应的实质是酸碱中和,都是放热反应,两个反应生成水的物质的量都是1mol,但是CH3COOH(aq)是弱电解质,电离过程吸收一部分热量,所以后者放出的热量小,所以△H3<△H4 , 故选B. △H为化学反应的焓变,放热反应的△H<0,吸热反应的△H>0;反应的热效应与反应物和生成物的状态有关,反应放出热量越大,焓变数值越小,据此进行解答.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】已知二甲苯有3种同分异构体,二甲苯中苯环上的一溴代物共有6种,其熔点见下表:
6种一溴二甲苯的熔点/℃ | 234 | 206 | 213.8 | 204 | 214.5 | 205 |
对应二甲苯的熔点/℃ | 13 | ﹣54 | ﹣27 | ﹣54 | ﹣27 | ﹣54 |
由此推断熔点为234℃的一溴二甲苯可能是( )
A.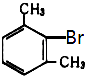
B.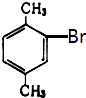
C.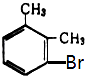
D.
【题目】下列说法正确的是
A | 在恒容密闭容器中,可逆反应C(s)+H2O(g) | 正反应选率将逐渐增大 |
B | 比较硅和碳的还原性 | 利用反应:SiO2+2C |
C. | 氯气具有漂白性 | 氯气通入滴有酚酞的NaOH溶液,溶液褪色 |
D | 证明氯气与水反应生成酸性物质,且该反应为可逆反应 | 少量氯气通入大量水中,测定溶液pH<7且显浅黄绿色 |
A. A B. B C. C D. D