题目内容
【题目】取50mL![]() 和
和![]() 的混合溶液,加入过量的
的混合溶液,加入过量的![]() 溶液后得到29.02g
溶液后得到29.02g
白色沉淀,用过量的稀硝酸处理后沉淀质量减少到9.32g,并有气体放出,试计算:
(1)原混合溶液中![]() 的物质的量_________
的物质的量_________
(2)![]() 的物质的量浓度__________
的物质的量浓度__________
【答案】 0.04mol 2mol/L
【解析】试题分析:本题考查物质的量应用于化学方程式的计算。Na2CO3和Na2SO4的混合溶液中加入过量BaCl2,产生BaSO4和BaCO3沉淀共29.02g;沉淀用过量稀硝酸处理,BaCO3溶解,BaSO4不溶,9.32g为BaSO4的质量。
(1)根据SO42-守恒,n(Na2SO4)=n(BaSO4)=![]() =0.04mol。
=0.04mol。
(2)m(BaCO3)=29.02g-9.32g=19.7g,根据CO32-守恒,n(Na2CO3)=n(BaCO3)=![]() =0.1mol,c(Na2CO3)=
=0.1mol,c(Na2CO3)=![]() =2mol/L。
=2mol/L。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】为有效控制雾霾,各地积极采取措施改善大气质量.研究并有效控制空气中氮氧化物、碳氧化物含量显得尤为重要. 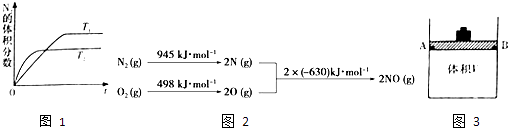
(1)氮氧化物研究 (i)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应:2NO(g)+O2(g)2NO2(g),下列各项能说明该反应达到平衡状态的是 .
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1molO2 , 同时生成2molNO2
(ii)在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图1所示,根据图像判断反应N2(g)+O2(g)2NO(g)的△H0(填“>”或“<”).
(iii)NOx是汽车尾气中的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图2:出该反应的热化学方程式: .
(2)碳氧化物研究 (i)在体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图3所示,现将3molNH3和2molCO2放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
CO(g)+2H2(g)CH3OH(g)
测定不同条件、不同时间段内的CO的转化率,得到如下数据:
10min | 20min | 30min | 40min | |
T1 | 30% | 55% | 65% | 65% |
T2 | 35% | 50% | a1 | a2 |
①根据上表数据,请比较T1T2(选填“>”、“<”或“=”);T2℃下,第30min 时,a1= , 该温度下的化学平衡常数为 .
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人6molCO,此时v(正)v (逆)(选填“>”、“<”或“=”),判断的理由是 .
(ii)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO﹣),则该混合溶液中醋酸的电离常数Ka=(用含a和b的代数式表示)
【题目】Si3N4是一种重要的新型无机非金属材料,能被强碱腐蚀;实验室可利用SiCl4蒸气和NH3在1400℃、无水、无氧条件下反应制取氧化硅,实验装置示意图(加热和夹持装置略去)和有关性质如下: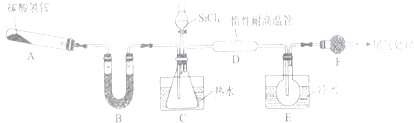
物质 | 熔点/℃ | 沸点/℃ | |
SiCl4 | ﹣70 | 57.7 | 难溶解NH3和无机盐,在潮湿空气中极易水解 |
Si3N4 | 1900 | ﹣ | 性质稳定 |
请回答下列问题:
(1)装置B中所加入的试剂名称为 .
(2)装置C中的锥形瓶需要热水浴,热水浴加热的优点为 .
(3)反应开始前先组装好仪器,(填操作步骤)后,再加装药品,接下来的操作是(请按正确的顺序填写下列步骤的序号).
①滴加SiCl4②加热装置D ③加热装置A
(4)装置D中发生反应的化学方程式为 .
(5)反应过程中,装置E中的现象为 .
(6)测定产品中 Si3N4的含量,步骤为:
ⅰ.反应结束后,取200.0g装置D中的物质,加入足量NaOH溶液,充分加热反应;
ⅱ.将生成的气体全部被200.0mL3.000molL﹣1盐酸吸收(溶液体积变化忽略不计);
ⅲ.取吸收后所得溶液20.00mL,用0.2500molL﹣1NaOH溶液滴定过量盐酸;
ⅳ.重复滴定3次,平均消耗NaOH溶液32.00mL.
①步骤ⅰ中发生反应的离子方程式为 .
②产品中Si3N4的质量分数为(保留3位有效数字)
(7)Si3N4抗腐蚀能力很强,但易被氢氟酸腐蚀,反应生成四氟化硅和一种铵盐,该盐的化学式为 .




