题目内容
【题目】在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)降低温度,化学反应速率__(填“增大”“减小”或“不变”)。
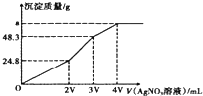
(2)600℃时,在一容积为2L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10min和20min时,分别改变了影响反应速率的一个条件,反应过程中SO2、O2、SO3物质的量变化如图所示,前10min正反应速率逐渐___(填“增大”“减小”或“不变”);前15 min内用SO3表示平均反应速率为__。
(3)图中反应进程,表示正反应速率与逆反应速率相等的时间段是___。
(4)根据上图判断,10min时改变的反应条件可能是___(填编号,下同);20min时改变的反应条件可能是___。
A.加入催化剂 B.缩小容器容积
C.降低温度 D.增加O2的物质的量
【答案】减小 减小 1.33×10-3mol/(Lmin) 15~20min和25~30min AB D
【解析】
(1)结合温度对速率的影响分析。
(2)10~15min反应物浓度逐渐减小、生成物浓度逐渐增大,说明正反应速率逐渐减小、逆反应速率逐渐增大;根据n=![]() 计算前15min内用SO2表示的平均反应速率;
计算前15min内用SO2表示的平均反应速率;
(3)当反应达到化学平衡状态时,各组分的浓度不随时间的变化而变化;
(4)10min到15min的时间段,化学反应速率加快,二氧化硫和氧气的量减小,三氧化硫的量增加;反应进行至20min时,氧气的物质的量增加,二氧化硫的减少,三氧化硫的增加,据此分析。
(1)降低温度,化学反应速率减小;
(2)根据图示可知,10~15min反应物浓度逐渐减小、生成物浓度逐渐增大,说明正反应速率逐渐减小;15min时三氧化硫的物质的量为0.04mol,前15min内用SO3表示的平均反应速率为:v(SO3)=![]() =1.33×10-3mol/(Lmin);
=1.33×10-3mol/(Lmin);
(3)根据图示曲线变化可知,15~20min、25~30min时间段,各组分的浓度不随时间的变化而变化,说明反应达到化学平衡状态;
(4)根据图象所示信息,10min到15min的时间段,化学反应速率加快,可以是加了催化剂或者是增大压强,或缩小容器体积,故答案为AB;反应进行至20min时,氧气的物质的量增加,二氧化硫的减少,三氧化硫的增加,可以推断是增加了O2的量,故答案为D。

【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
【题目】下列实验能达到预期目的是
实验内容 | 实验目的 | |
A | 向某未知溶液中加入 | 检验是否含 |
B | 向某未知溶液中加入NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含 |
C | 加热分别用 | 探究 |
D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
A.AB.BC.CD.D